(Thulium; от лат. назв.Скандинавии - Thule), Tm - химический элемент III группы периодической системы элементов; ат. н. 69, ат. м. 168,9342; относится к редкоземельным элементам. Металл светло-серого цвета. В соединениях проявляет степень окисления +3 ( >3). Известны с массовыми числами от 165 до 175. Из них практическое значение имеет изотоп 170Тm. Открыл тулий (1879) швед, химик П. Клеве.
Металлический тулий впервые получили амер. ученые Ф. Спеддинг и А. Даан. Содержание тулия в земной коре 8·10 -5 %. Основным минералами для получения тулия служат и эвксенит. Кристаллическая решетка тулий гексагональная плотно-упакованная типа магния, с периодами а = 3,5374 А и с = 5,558 А. Плотность (т-ра 25° С) 9,314 г/см3; tпл1545°С; tкип 1727°С; коэффициент термического расширения 13,3-10-6 град; теплоемкость 6,46 кал/г-атом град; электрическое сопротивление 90 мком-см; точка 22 К; работа выхода электронов 3,12 эв. Модуль норм, упругости 7710 кгс/мм2; модуль сдвига 3100 кгс/мм2; коэфф. Пуассона 0,235; НВ = 55 (металла 99,0%).
Тулий легко поддается механической обработке. Химически активен. На воздухе сильно окисляется. Образует и соединения со мн. элементами. Тулий получают металлотермическим восстановлением окислов лантаном при т-ре 1000- 1500° С. Для получения чистого металла тулий дистиллируют. Тулий выпускают в виде небольших слитков. Изотоп 170Тm находит применение в портативных рентгенопросвечивающих аппаратах.
Лит.: Герасимовский В. И. Геохимия редкоземельных элементов. В кн.: Редкоземельные элементы (Получение, анализ, применение).
Статья на тему Тулий химический элемент
Thule - так во времена Римской империи называли Скандинавию, север Европы. Тулием назван элемент, открытый Клеве в 1879 г. Сначала Клеве нашел новые спектральные линии, а затем первым выделил из гадолинита бледно-зеленую окись элемента № 69.
Распространение тулия
По данным академика А. П. Виноградова, тулий - самый редкий (если не считать прометия) из всех редкоземельных элементов. Содержание его в земной коре 8*10 -5 %. По тугоплавкости тулий второй среди лантаноидов
: температура его плавления 1550-1600° С (в справочниках приводятся разные величины; дело, видимо, в неодинаковой чистоте образцов). Лишь лютецию уступает он и по температуре кипения.
Несмотря на минимальную распространенность, тулий
нашел практическое применение раньше, чем многие более распространенные лантаноиды. Известно, например, что микропримеси тулия вводят в полупроводниковые материалы (в частности, в арсенид галлия) и в материалы для лазеров. Но, как это ни странно, важнее, чем природный стабильный тулий (изотоп 16STm), для нас оказался радиоактивный тулий-170.
Тулий-170 образуется в атомных реакторах при облучении нейтронами природного тулия. Этот изотоп с периодом полураспада 129 дней излучает сравнительно мягкие гамма-лучи с энергией 84 Кэв (энергия жесткого гамма- излучения измеряется не килоэлектронвольтами, а Мэвами - миллионами электронвольт).
На основе этого изотопа были созданы компактные рентгенопросвечивающие установки, имеющие массу преимуществ перед обычными рентгеновскими аппаратами. В отличие от них тулиевые аппараты не нуждаются в электропитании, они намного компактнее, легче, проще по конструкции. Миниатюрные тулиевые приборы пригодны Для рентгенодиагностики в тех тканях и органах, которые трудно, а порой и невозможно просвечивать обычными рентгеновскими аппаратами.
Гамма-лучами тулия просвечивают не только живые ткани, но и металл. Тулиевые гамма-дефектоскопы очень удобны для просвечивания тонкостенных деталей и сварных швов. При работе с образцами толщиной не больше 6 мм эти дефектоскопы наиболее чувствительны. С помощью тулия-170 были обнаружены совершенно незаметные письмена и символические знаки на бронзовой прокладке ассирийского шлема IX в. до н. э. Шлем обернули фото-пленкой и стали просвечивать изнутри мягкими гамма-лучами тулия. На проявленной пленке появились стертые временем знаки...
Кроме дефектоскопов, препараты тулия-170 используют в приборах, называемых мутнометрами. По рассеянию гамма-лучей этими приборами определяют количество взвешенных частиц в жидкости.
Для тулиевых приборов характерны компактность, надежность, быстродействие. Единственный их недостаток - сравнительно малый период полураспада тулия-170. Но тут уж, как говорится, ничего не попишешь.
Тулиевые гамма-исгочники становятся дешевле по мере увеличения их производства. Еще в 1961 г. в нашей стране выпускались тулиевые источники пяти типов, и стоили они от 5,5 до 250 рублей. А килограмм металлического стабильного тулия в то же время стоил более 25 тыс. рублей.
Новая, более совершенная технология получения лантаноидов позволила в последнее время значительно уменьшить цены на них. В 1970 г. цена тулия составляла уже 13 тыс. рублей за килограмм. Но, и став почти вдвое дешевле, он по-прежнему остается самым редким и самым дорогим из всех лантаноидов.
Легко поддается обработке и имеет серебристо-белый цвет. Несмотря на его редкость и высокую цену, тулий применяется в перспективных твердотельных лазерах и в виде радиоизотопа в портативных рентгеновских аппаратах.
1. История
Туллий был открыт шведским химиком Пером Теодором Клеве в как примесь к оксидов других редкоземельных элементов (был использован метод, которому было предложено Карлом Густавом Мозандером для поиска и выделения новых редкоземельных элементов). Клеве отделил все известные примеси из эрбия - "земли" (оксида) элемента ( 2 3). После дополнительных процедур Клеве выделил две новые субстанции: одну коричневого цвета, другую зеленого. Коричневой была земля, которую Клеве предложил назвать "гольмию" и которая соответствует элементу гольмий , зеленый же землю он назвал "Туллия" и новой элемент Туле в честь Thule, латинского названия Скандинавии .
Туллий был настолько редким, что у одного из ранних исследователей не было его в достаточном количестве, чтобы иметь возможность его достаточно очистить, чтобы увидеть зеленый цвет его соединений, им приходилось радоваться хотя бы потому, что характерные спектральные линии тулия усиливались, когда из образца постепенно удаляли эрбий . Первым исследователем, получил достаточно чистую тулия (оксид тулия), был Чарльз Джеймс, из колледжа в Дареме , Нью-Гемпшир . В 1911 он сообщил о том, что фракционная кристаллизация бромата позволила ему выделить чистый материал. Он провел 15 000 "операций" кристаллизации для установки гомогенности его материала.
Оксид тулия высокой чистоту впервые стал коммерчески доступен с конца 1950-х, в результате совершенствования метода ионно-обмена технологий разделения. Подразделение Lindsay Chemical Division фирмы American Potash & Chemical Corporation предложила сорта 99% и 99,9% чистоты. Цена за килограмм колебалась между US $ 4600 и $ 13300 в период с к для препарата 99,9% чистоты, это была самая высокая цена на лантаноидов после лютеция .
2. Распространенность и производство
Этот элемент никогда не встречается в природе в свободном состоянии, однако он содержится в небольших количествах в минералах с другими редкоземельными элементами. Его содержание в земной коре составляет 0,5 мг / кг. Туллий в основном добывают из монациту (~ 0,007% тулия) - руды, содержащийся в некоторых песках, с помощью технологий ионного обмена. Новые ионно-обменные технологии и технологии экстракции с помощью органических растворителей позволили эффективно и более легко выделять тулий, сокращая расходы на его добычу. Главным источником тулия на сегодня глинистые месторождения южного Китая. В таких минералах, где иттрий составляет 2/3 от всего редкоземельного компонента руды, всего 0,5% тулия. После выделения Металл может быть выделенным путем восстановления его оксида лантаном или кальцием в закрытом реакторе при высоких температурах. По другому методу, тулий восстанавливают с фторида металлотермическим кальцием:
2TmF 3 + 3Ca = 3CaF 2 + 2Tm
3. Химические свойства
Тулий медленно, а при высокой температуре активно реагирует с кислородом воздуха с образованием тулий (III) оксида:
4 Tm + 3 O 2 → 2 Tm 2 O 3
Медленно реагирует с водой, однако реакция ускоряется при нагревании с образованием гидроксида:
2 Tm + 6 H 2 O → 2 Tm (OH) 3 + 3 H 2 2 Tm + 3 F 2 → 2 TmF 3 [соль белого цвета] 2 Tm + 3 Cl 2 → 2 TmCl 3 [соль желтого цвета] 2 Tm + 3 Br 2 → 2 TmBr 3 [соль белого цвета] 2 Tm + 3 I 2 → 2 TmI 3 [соль желтого цвета]
4.2. Источники рентгеновского излучения
Несмотря на свою высокую стоимость, в портативных рентгеновских аппаратах в качестве источника излучения используются тулий, который был облученного нейтронами в ядерном реакторе. Эти источники активны в течение примерно одного года, как инструмент в мобильных медицинских и стоматологических пунктах, а также для выявления дефектов в труднодоступных механических и электронных компонентах. Такие источники не требуют серьезного радиационной защиты - достаточно небольшого покрытие из свинца.
5. Биологическая роль и предостережения
Биологических роль тулия не известна, хотя было отмечено, что он несколько стимулирует обмен веществ. Растворимые соли тулия есть немного токсичными, если их введено в организм в больших количествах, но нерастворимые соли нетоксичны. Туллий не всасывается корнями растений, и поэтому не попадает в пищевую цепь человека. Овощи обычно содержат только один миллиграмм тулия за тонну сухого веса).
Литература
- Глоссарий терминов по химии / / Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им.. Л.М.Литвиненка НАН Украины, Донецкий национальный университет - Донецк: "Вебер", 2008. - 758 с. ISBN 978-966-335-206-0
Электронная конфигурация атома - это формула, показывающая расположение электронов в атоме по уровням и подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему. Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину. Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов - 16й элемент периодической системы. Золото имеет 79 протонов - 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
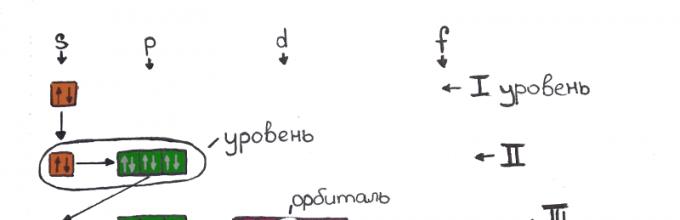
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин "орбиталь", орбиталь - это волновая функция электрона, грубо - это область, в которой электрон проводит 90% времени.
N - уровень
L - оболочка
M l - номер орбитали
M s - первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии, облако принимает четыре основных формы: шар, гантели и другие две, более сложные. В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой. На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f) орбиталей. Орбитальное квантовое число - это оболочка, на которой находятся орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно принимает значения 0,1,2 или 3.
На s-оболочке одна орбиталь (L=0) - два электрона
На p-оболочке три орбитали (L=1) - шесть электронов
На d-оболочке пять орбиталей (L=2) - десять электронов
На f-оболочке семь орбиталей (L=3) - четырнадцать электронов
Магнитное квантовое число m l
На p-оболочке находится три орбитали, они обозначаются цифрами от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали "-1", "0" и "1". Магнитное квантовое число обозначается буквой m l .
Внутри оболочки электронам легче располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять электронов заполняют оболочку принимая значения M l =-2,M l =-1,M l =0, M l =1,M l =2.
Спиновое квантовое число m s
Спин - это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с противоположными спинами. Спиновое квантовое число обозначается m s
Главное квантовое число n
Главное квантовое число - это уровень энергии, на данный момент известны семь энергетических уровней, каждый обозначается арабской цифрой: 1,2,3,...7. Количество оболочек на каждом уровне равно номеру уровня: на первом уровне одна оболочка, на втором две и т.д.
Номер электрона

Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0, магнитное квантовое число может принять только одно значение, M l =0 и спин будет равен +1/2. Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут: N=2, L=1, M=-1, спин 1/2.
В таблице Менделеева насчитывается немало химических элементов которые названы по географическим названиям. Их можно разделить на очевидные или неочевидные. Очевидные географические названия химических элементов, как видно из наименования, прямо указывают на топонимы, среди них, например, америций. Более интересна вторая группа, куда входят неочевидные для русскоязычного читателя географические названия химических элементов, как пример можно привести рутений — от лат. Россия. Итак, рассмотрим все такие элементы по отдельности.
- Европий названный в честь Европы был открыт французским химиком Эженом Демарсе, который получил его в 1901 году и дал ему название.
- Америций был получен искусственно в 1944 году в Металлургической лаборатории Чикагского университета Гленном Сиборгом с сотрудниками. Внешняя электронная оболочка нового элемента (5f) оказалась аналогичной европию (4f). Поэтому элемент назвали в честь Америки, как европий - в честь Европы.
- Бериллий так назван в честь минерала берилл, который в свою очередь ведет свое наименование от индийского города Белур. В Индии существует множество месторождений изумрудов, которые являются разновидностью берилла. Любопытно, что первоначально бериллий называли «глиций» (от греч. гликос — сладкий), т.к. он имеет сладковатый привкус.
- Берклий получил свое название от города Беркли, именно там в 1949 году был получен это радиоактивный элемент.
- Галлий происходит от латинского Gallia - Франция. Существование галлия было научно предсказано Д. И. Менделеевым. Открытие галлия укрепило позиции Периодического закона, ярко продемонстрировав возможность предвидения открытия новых химических элементов. Галлий был открыт французским химиком Полем Эмилем Лекоком де Буабодраном в 1875 году.
- Гафний назван так в честь Копенгагена, в котором был открыт. В переводе с латинского Hafnia — Копенгаген.
- Германий элемент получил название в честь родины учёного Клеменса Винклера, открывшего элемент, Германии
- Гольмий получил свое наименование от старинного имени Стокгольма — Holmia. Именно там был найден минерал, из которого в 1879 году был выделен новый химический элемент
- Дармштадтий — происходит от немецкого «наукограда» Дармштадт,в котором в 1994 году был синтезирован этот элемент.
- Дубний . А это уже российский «наукоград» физиков и химиков — подмосковный город Дубна. Дубний был получен в этом городе в 1970 году. Советские ученые предложили название нового элемента нильсборий, в честь Нильса Бора. Также предлагались такие названия, как ганий и жолиотий. Однако, в 1997 году этот химический элемент получил официальное название Дубний.
- Иттрий
- Иттербий
- Терий
- Эрбий . Все вышеперечисленные 4 химических элемента найдены в минерале из карьера близ селения Иттербю на острове Ресарё недалеко от Стокгольма и поэтому получили свое название в честь этого населенного пункта.
- Калифорний ведет название от штата Калифорния в США, получен в 1950 году в г.Беркли, который находится в Калифорнии.
- Ливерморий назван так в честь Ливерморской национальной лаборатории имени Лоуренса (г.Ливермор, шт.Калифорния, США), в которой был впервые синтезирован этот химический элемент.
- Лютеций . Париж ранее назывался Лютеция, химический элемент был открыт в 1907 году французским химиком Ж. Урбэном.
- Магний . Латинское название элемента магний Magnesium происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
- Марганец в древности был известен под названием «чёрная магнезия». В начале XIX века для него было принято название «манганум» (от немецкого Manganerz - марганцевая руда).
- Полоний назван так в честь родины выдающейся ученой Марии Склодовской-Кюри Польши.
- Рений открыли в 1925 году немецкие химики Ида и Вальтер Ноддак. Элемент получил название от Рейнской провинции в Германии откуда родом была Ида Ноддак.
- Рутений был открыт профессором Казанского университета Карлом Клаусом в 1844 году, который назвал рутений в честь России (Ruthenia - латинское название Руси/России)
- Скандий это ничто иное как Скандинавия, элемент в 1879 году шведским химиком Ларсом Нильсоном.
- Стронций был обнаружен в минерале стронцианите, найденном в 1764 году в свинцовом руднике близ шотландской деревни Стронтиан, давшей впоследствии название новому элементу.
- Тулий был так назван шведским химиком П. Т. Клеве дал ему название в честь расположенного на севере Европы мифического острова Туле (Thule)
- Франций был открыт в 1939 г. Маргаритой Перей, сотрудницей Института радия в Париже. Она же и дала ему в название в честь своей родины - Франции.
- Хассий впервые был получен в 1984 в Центре исследования тяжёлых ионов (Дармштадт, Германия). Получил свое название от наименования федеральной земли Гессен; Hassia — латинское название княжества, а затем великого герцогства Гессен-Дармштадт, в котором и находится этот научный Центр.
- Медь . Русское слово не имеет четко выраженной этимологии, а вот латинское название этого металла Cuprum восходит к древнему названию острова Кипр (Aes cuprium, Aes cyprium), на котором имеются очень богатые залежи меди.
Как мы видим, существует немало химических элементов, которые получили свое название от географических наименований. А вот от названия химического элемента в географию перекочевало только одно имя — Аргентина, которая получила свое название от латинского слова Argentum, обозначающего серебро.
Помимо того что географические названия получали химические элементы, также из географии были заимствованы наименования для обозначения химических веществ и минералов.
Географические названия химических веществ и минералов
- Веронал получил свое название от итальянского города Верона. Веронал, он же барбитал, — это снотворное лекарственное средство, считается психотропным веществом.
- Одеколон — «кёльнская вода» или по-французски eau de Cologne. Рецепт одеколона был создан итальянским парфюмером Йоганном Марией Фарина в городе Кёльне, Германия. Первоначально в состав одеколона входили спирт, масла мандарина, грейпфрута, апельсина, а также масляные эссенции трав и кедра.Мануфактура, основанная им еще в 1709 году, действует и по сей день и является старейшей в мире. Одеколон по своей сути есть ни что иное как духи. Во времена Наполеона парфюмерия считалась лекарственным средством и когда в 1810 году император приказал обнародовать составы всех лекарств, владельцам парфюмерной мануфактуры пришлось пойти на хитрость. Они добавили к составу одеколона три дополнительных компонента: бергамот, нероли и лимон и назвали всё это дело «Одеколон». Так рецепт знаменитых духов остался в тайне. Но наши современники разгадали этот рецепт. Попробуйте сделать одеколон сами, парфюмерия своими руками это совсем несложное дело!
- Полудрагоценный камень топаз получил свое название по месту своей первой находки. Впервые он был обнаружен на острове Топазиос (Топазион). Остров находится в Красном море на юге Египта и в настоящее время носит название Сент-Джонс. Уральские рудокопы называли топаз «тяжеловес», т.к. минерал очень тяжёлый.
- Ценный строительный материал алебастр получил своё название от названия города Басра в Ираке. В переводе с арабского слово «аль-басра» означает «мягкий» и связано с особенностями местной почвы. Другие названия алебастра — гипс, а химическое наименование — диаквасульфат кальция.
Предлагаем вам закрепить свои знания и дать ответы на вопросы викторины «