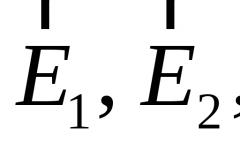Все самопроизвольные процессы всегда сопровождаются понижением энергии системы.
Таким образом, направление самопроизвольного протекания процесса в любых системах определяет более общий принцип – принцип минимума свободной энергии.
Для характеристики процессов, протекающих в закрытых системах, были введены новые термодинамические функции состояния: а) свободная энергия Гиббса
∆G = ∆H - T ∆S (р , Т = const); (17)
б)свободная энергия Гельмгольца
∆F = ∆U - T ∆S (V ,T = const). (18)
Энергии Гиббса иГельмгольца измеряются в единицахкДж/моль.
Свободная энергия это как раз та часть энергии, которая может быть превращена в работу (см. ур.10). Она равна максимальной работе, которую может совершить система ∆G = - А макс .
В реальных условиях А макс никогда не достигается, так как часть энергии рассеивается в окружающую среду в виде тепла, излучения, тратится на преодоление трения и т.д., что и учитывается введением КПД.
Таким образом, 1) самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; 2) система приходит в состояние равновесия, когда изменение свободной энергии становится равным нулю.
Вычисления изменений функции Гиббса (Гельмгольца), или свободной энергии, дают возможность сделать однозначные выводы о способности химических реакций к самопроизвольному протеканию в данных условиях.
Протекание самопроизвольных процессов всегда сопровождается уменьшением свободной энергии системы (DG < 0 или DF < 0).
Энергетические диаграммы, отвечающие термодинамически запрещенным, равновесным и самопроизвольным химическим процессам, представлены на рис.4.
ΔG , кДж/моль
Продукт ∆G > 0
 термодинамически
термодинамически
Запрещенный процесс
Продукт
![]() Исх. равновесие ∆G
= 0
Исх. равновесие ∆G
= 0
Продукт
∆G < 0
Самопроизвольный процесс
координата реакции Х
Рис. 4. Энергетические диаграммы термодинамически запрещенных, равновесных и самопроизвольных химических процессов
Условиями термодинамического равновесия в закрытой системе при различных условиях ведения процесса являются:
Изобарно-изотермические (р = const, T = const): ΔG = 0,
Изохорно-изотермические (V = const, T = const): ΔF = 0.
Таким образом, единственным критерием самопроизвольности химических процессов служит величина изменения свободной энергии Гиббса (или Гельмгольца), которая определяется двумя факторами: энтальпийным и энтропийным
∆G = ∆H - T ∆S ;
ΔF = ∆U - T ∆S .
Большинство химических процессов является результатом действия двух факторов: 1) стремление системы перейти в состояние с меньшей энергией, что возможно при объединении частиц или создании частиц, обладающих меньшим запасом внутренней энергии (или энтальпии); 2) стремление системы к достижению состояния с более высокой энтропией, что отвечает более беспорядочному расположению частиц.
При низких температурах, когда тепловое движение частиц замедляется, преобладает первая тенденция.
С ростом температуры энтропия возрастает (см.рис. 2 и 3) и начинает превалировать вторая тенденция, т.е. стремление к достижению такого состояния системы, которое характеризуется большей неупорядоченностью.
При очень высоких температурах не может существовать ни одно химическое соединение. Любые соединения в этих условиях переходят в газообразное состояние и распадаются (диссоциируют) на свободные атомы, а при температурах плазмы (Т > 10000 К) - на ионы, электроны и свободные радикалы, что соответствует наибольшей неупорядоченности системы, а следовательно, и максимальной энтропии.
Для определения, какой из факторов энтальпийный или энтропийный являются определяющими в данных условиях ведения процесса, производят сравнение абсолютных величин:
÷ ∆H ÷ > ÷ T ∆S ÷ – определяющим является энтальпийный фактор,
÷ ∆H ÷ < ÷ T ∆S ÷ - определяющим является энтропийный фактор.
В химии наиболее часто пользуются величиной энергии Гиббса, так как большинство химических и биологических процессов протекают в открытых (р = р атм) или закрытых сосудах при постоянном давлении (р ¹ р атм) и поэтому в дальнейшем, чтобы не повторяться в отношении величины ΔF , если это специально не оговорено, мы будем оперировать величиной ∆G .
Для определения направления химического процесса типа аА + вВ = сС + дД, протекающего в стандартных условиях, величину ΔG хр можно рассчитать по значениям ΔH 0 298хр и DS 0 298хр, используя ур.19. Если температура процесса Т ≠ 298 К, то расчет ведут по ур. 20.
∆G 0 298хр = ΔH 0 298хр - 298∙DS 0 298хр, (19)
∆G 0 Т хр ≈ ΔH 0 298хр - T DS 0 298хр. (20)
Можно воспользоваться и таблицами стандартных термодинамических функций образования веществ ΔG ° 298обр. В этом случае ΔG ° 298хр реакции рассчитывают аналогично ΔН ° 298хр:
∆G 0 298хр = [с∆G 0 298обр(С) + д∆G 0 298обр(Д) ] – [а∆G 0 298обр(А) + в∆G 0 298обр (В) ]. (21)
Таким образом, чтобы определить, возможен или нет химический процесс в данных условиях, необходимо определить, каким будет знак изменений энергий Гиббса или Гельмгольца.
Часто требуется определить температуру, называемую температурой инверсии, выше или ниже которой реакция меняет свое направление на обратное. Температура инверсии определяется из условия равновесия реакции ∆G хр = 0 .
∆G хр = ΔH хр - T DS хр = 0 (22)
Т инв = ΔH хр / DS хр. (23)
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Определите возможное направление самопроизвольного протекания процесса при t = 100°С. Рассчитать температуру инверсии.
Si (к) + SiO 2(к) = 2SiO (к)
Рассчитаем величину DG ° 298 этой реакции. Воспользуемся табличными данными
∆ H 0 298 , кДж/моль 0 -912 -438
S 0 298 , Дж/моль∙К 19 42 27
∆Н 0 298 хр = = 36 кДж;
∆ S 0 298 хр = = -7 Дж/К;
∆ G ° хр = ∆H 0 298 хр - T ∆S 0 298 хр =36 - 373×(-7)×10 -3 = 38,6 кДж.
Видно, что величина ∆G ° хр положительна, и при 373 К реакция в прямом направлении протекать не может. Следовательно, SiO 2 устойчив в стандартных условиях.
Для того, чтобы узнать возможен ли в принципе переход SiO 2 в SiO при каких – либо других температурах, надо рассчитать температуру инверсии, при которой система находится в состоянии термодинамического равновесия, т.е. в условиях, когда ∆ G = 0.
Т инв = ∆ H ° 298 хр /∆ S ° 298 хр = 36/(-7.10 -3)= -5143 К.
Отрицательной температуры в шкале абсолютных температур не существует и, следовательно, ни при каких условиях переход двуокиси кремния в окись кремния невозможен.
Fe 3 O 4(к) + 4H 2(г) = 3Fe (к) + 4H 2 O (г)
∆Н ° 298 обр, кДж/моль -1118 0 0 -241,8
В соответствии со следствием из закона Гесса изменение энтальпии процесса равно:
∆Н ° 298 хр = 4∆Н ° 298 обр (Н 2 О) – ∆Н ° 298 обр (Fe 3 O 4) = 4(-241,8) - (-1118) = 150,8 кДж
Изменение энтальпии реакции в данном случае рассчитано на 3 моль железа, т.е. на 3 моль ∙ 56 г/моль = 168 г.
Изменение энтальпии при получении 1кг железа определяется из соотношения:
168 г Fe - 150,8 кДж;
1000 г Fe - Х кДж;
Отсюда Х = 897 кДж.
Определить верхний предел температуры, при которой может протекать процесс образования пероксида бария по реакции:
2BaO (к) + O 2(г) = 2BaO 2(к)
Изменение энтальпии и энтропии реакции образования пероксида бария имеют следующие значения:
∆Н ° 298 хр = 2∆Н ° 298 обр (ВаО 2) - (2∆Н ° 298 обр (ВаО) + ∆Н ° 298 обр (О 2))
∆Н ° 298 хр = -634,7∙2 - (-553,9∙2 + 0) = -161,6 кДж
∆S ° 298 хр = 2S ° 298 обр (ВаО 2) – (2S ° 298 обр (ВаО) + S ° 298 обр (О 2))
∆S ° = 77,5∙2 – (70,5∙2 + 206) = -191 Дж/К = - 0,191 кДж/К
Свободная энергия этого процесса выразится уравнением
∆G ° хр = -161,6 + 0,191×Т.
При стандартных условиях ∆G ° 298хр = -161,6 + 0,191×298 = -104,68 кДж. ∆G ° 298хр < 0 и реакция при стандартных условиях протекать может.
Температуру инверсии можно найти из соотношения ∆G ° = 0.
∆G ° = -161,6 + 0,191Т = 0
Отсюда Т = - 161,6 - 0,191 = 846,07 К
Ниже температуры 846,07 К, процесс образования BaO 2 может быть реализован.
Вычислить изменение энтропии при испарении 250 г воды при 25 °С, если мольная теплота испарения воды при этой температуре равна 44,08 кДж/моль.
РЕШЕНИЕ. При испарении энтропия вещества возрастает на величину
∆S исп = DН / Т.
250 г воды составляют 250 г/18 г/моль = 13,88 моль. Отсюда теплота испарения воды равна: 13,88 моль ∙ 44,08 кДж/моль = 611,83 кДж.
Изменение энтропии при испарении 250 г воды при Т = 25 +273 = 298 К равно
∆S исп = 611,83 / 298 = 2,05 кДж.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
СО (г) + Н 2 О (г) = СО 2(г) + Н 2(г)
Определить: а) ∆U ° 298 реакции; б) сколько граммов и сколько литров СО вступило в реакцию, если выделилось 14,66 кДж тепла (н.у.)?
СН 4(г) + 2О 2(г) = СО 2(г) + 2H 2 О (ж )
Определить; а) ∆U ° 298 реакции; б) сколько тепла выделится при сжигании 56 л метана (н.у)?
3. Для реакции СО (г) + С1 2(г) = COС1 2(г) , пользуясь табличными данными, рассчитать ∆Н ° 298 реакции. Вычислить: а) ∆U ° 298 реакции; б) сколько литров СО вступило в реакцию, если выделилось 338,13 кДж тепла (н.у.)?
2НС1 (г) + Са (тв) = СаС1 2(тв) + H 2(г) .
5. ∆Н ° 298 сгорания метана СН 4 равна - 891,6 кДж/моль. Вычислить: а) сколько тепла выделится при сгорании 1г метана; б) сколько тепла выделится при сгорании 5л метана (н.у.)?
6. Для реакции 2Сu (тв) + 1/2О 2(г) = Сu 2 О (тв) , ∆Н° 298 которой составляет -167,6 кДж, рассчитать: а)сколько литров кислорода вступило в реакцию, если выделилось 335,2 кДж тепла? б) ∆U ° 298 реакции.
7. ∆Н
° 298 реакцииCd (тв) + 1/2О 2(г) = CdО (тв) составляет -256,43 кДж.
Определить: а) ∆U
° 298 реакции; б) сколько молей Cd необходимо взять, чтобы выделилось 628 кДж тепла?
8. ∆Н
° 298 реакции 2Вi (тв) + 3/2О 2(г) = Вi 2 О 3 (тв) составляет -578,22 кДж.
Сколько тепла выделится при образовании 0,5 моль Вi 2 О 3 ?
9. По табличными значениями ∆Н ° 298 образования реагентов рассчитать ∆Н ° 298 сгорания метана СН 4 и ацетилена С 2 H 2 , если сгорание идет до СО 2(г) и H 2 О (ж) . Определить, какой газ обладает большей теплотворной способностью (кДж/кг).
10.Сожжены равные массы водорода, фосфора, графита и магния. В каком случае выделится больше тепла?
11. Сожжены равные объемы водорода Н 2 и ацетилена С 2 H 2 . При каком процессе выделится больше тепла и во сколько раз, если в результате реакции образуется СО 2(г) и Н 2 О (ж) ?
12. Алюмотермическое восстановление моноксида никеля описывается уравнением
3NiO (тв) +2Al (тв) = Al 2 O 3(тв) +3Ni (тв)
Пользуясь значениями ∆Н ° 298 обр реагентов, рассчитать ∆Н ° 298хр. Определить:
а) ∆Н ° 298 хр в кДж на 1 моль Ni; б) ∆Н ° 298 хр в кДж на 1 кг Ni;
13. Пользуясь табличными значениями, определить ∆Н ° 298 хр:
С 2 H 4(г) +ЗО 2(г) = 2СО 2(г) + 2Н 2 О (ж) . Какое количество тепла выделится, если в реакцию вступило: а) 14г этилена; б) 112л этилена (н.у.).
14. Пользуясь табличными данными, вычислить, сколько тепла поглотится при образовании 100 кг СаС 2 по реакции СаО (тв) + 3С (графит) = СаС 2(тв) + СО (г) .
15. Энтальпия образования хлористого водорода составляет -92,5 кДж/моль. Сколько тепла выделится при взаимодействии 1л (н.у.) водорода с хлором?
16. Сколько тепла выделится при сгорании 38 г сероуглерода по реакции CS 2(г) + ЗО 2(г) = СО 2(г) + 2SO 2(г) ?
17. Разложение гремучей ртути протекает по уравнению
Hg(CNO) 2(тв) = Hg (ж) +2СО (г) +N 2(г) , ∆Н ° 298 хр = -364 кДж. Определить объем выделившихся газов и количество тепла при взрыве 1 кг Hg(CNO) 2 при н.у.
18. Сколько тепла выделится при взрыве 8,4 л гремучего газа (смесь О 2 и Н 2 в объемном соотношении 1: 2) при н.у., если в результате реакции образуется Н 2 О (ж) ?
19. Сколько тепла выделится при образовании 1 кг кремния по реакции
SiO 2(тв) + 2Mg (тв) = 2MgO (тв) + Si (тв) , если ∆Н ° 298 хр = -292 кДж.
20. Сколько тепла выделится при взаимодействии 1л (н.у.) водорода со фтором, если образование 1 г HF (г) сопровождается выделением 13,45 кДж тепла?
22. Сколько тепла выделится при восстановлении 8г СuО водородом с образованием Н 2 О (г) ?
23. Сколько тепла выделится при сгорании 112л (н.у.) водяного газа, состоящего из равных объемов водорода и оксида углерода (II), если в результате реакции образуется оксид углерода (IV) и водяной пар?
24. Вычислить количество тепла, выделившегося при взаимодействии 10 л аммиака (н.у.) с хлористым водородом по реакции: NH 3(г) + HCl (г) = NH 4 Cl (тв) .
25. Определить ∆Н ° 298 образования РН 3 по реакции
2PH 3(г) + 4O 2(г) = P 2 O 5(г) + ЗН 2 О (г) , если ∆Н ° 298 хр = -2829,74 кДж.
26. Вычислить ∆Н ° 298 образования диоксида кремния, если для реакции SiO 2(тв) +2Мg (тв) = 2МgO (тв) + Si (тв) , ∆Н ° 298 хр = -292 кДж.
27. Реакция горения метилового спирта протекает по уравнению
СН 3 ОН (ж) + 3/2О 2 (г) = СO 2(г) + 2Н 2 О (ж) . При этом сгорание 1 моля спирта сопровождается выделением 727,4 кДж тепла.
28. При сгорании некоторого количества н-бутана С 4 Н 10(г) выделилось 12,44 кДж тепла. Сколько н-бутана сгорело: а) граммов; б) литров, если ∆Н ° 298 сгорания этого вещества равно -2882,43 кДж/моль?
29. При восстановлении 80 г Fe 2 О 3(тв) алюминием выделилось 427,38 кДж тепла. Вычислить ∆Н ° 298 образования Fe 2 O 3 (тв) .
30. Для определения ∆Н ° 298 образования ZnОв калориметрической бомбе было сожжено 3,25 г металлического цинка, при этом выделилось 17,47 кДж тепла. Вычислить ∆Н ° 298 реакции окисления цинка кислородом.
31. При сгорании 3,6 г магния выделилось 90,5 кДж тепла. Рассчитать ∆Н ° 298 образования MgO.
32. При сгорании 11 г пропана С 3 Н 8 выделилось 556 кДж тепла. Рассчитать энтальпию образования С 3 Н 8(г) .
33. Реакция окисления аммиака в некоторых условиях протекает по уравнению 4NH 3(г) + 3O 2(г) = 2N 2(г) +6H 2 O (ж).
Образование 4,48 л азота при ну. сопровождается выделением 153,3 кДж тепла. Рассчитать ∆Н ° 298 химической реакции. Сколько тепла выделится при окислении 1 г аммиака?
34. Образование 1 г FeO (тв) сопровождается выделением 3,71 кДж тепла. Сколько тепла выделится при окислении кислородом 1 моль Fe (тв) ?
35. Вычислить ∆Н ° 298 следующего перехода: Н 2 О (ж) = Н 2 О (г) на основании данных для следующих реакций:
Н 2(г) + 1/2 О 2(г) = Н 2 О (г) , ∆Н ° 298 = -242,2 кДж,
Н 2 О (ж) = 1/2 О 2(г) + Н 2(г) , ∆Н ° 298 = +286,2 кДж.
36. Определить ∆Н ° 298 перехода ромбической серы в моноклиническую, если энтальпия сгорания ромбической серы составляет-297,96 кДж/моль, аэнтальпия сгорания моноклинической серы равна -300,53 кДж/моль.
37. ∆Н ° 298 образования НI (г) из кристаллического I 2 и газообразного Н 2 составляет 26 кДж/моль, а ∆Н ° 298 образования НI (г) из газообразных I 2 и Н 2 равна - 5,2 кДж/моль. Вычислить ∆Н ° 298 перехода I 2 (тв) = I 2 (г) .
2P (белый) + 3С1 2(г) = 2РС1 3(г) , ∆Н
° 298 = -559,4кДж,
РС1 3 (г) + С1 2(г) = РС1 5 (г), ∆Н
° 298 = -90,50 кДж.
39. Найти тепловой эффект реакции превращения 1 моля кислорода в озон, если 3As 2 O 3(тв) + 3 О 2(г) = 3 As 2 О 5 (тв) , ∆Н ° 298 = -1170,8 кДж,
3As 2 O 3(тв) + 2О 3 (г) = 3 As 2 O 5(тв) , ∆Н ° 298 = -886,2 кДж.
40. Определить расход тепла при разложении 1 кг Na 2 СO 3(тв) с образованием Na 2 O (тв) и СО 2 (г) , если известно, что:
Na 2 СО 3(тв) +SiO 2(тв) =Na 2 SiO 3(тв) + CO 2(г) , ∆Н
° 298 = 128,42 кДж,
Na 2 O (тв) + SiO 2(тв) = Na 2 SiO 3(тв) , ∆Н
° 298 = -207,40 кДж.
41. Пользуясь табличными значениями ∆G ° 298 образования веществ, определите возможное направление самопроизвольного протекания реакций: а) СО 2(г) + 2Н 2 О (ж) = СH 4(г) + 2О 2(г)
б) 2НВr (г) + С1 2(г) = 2НС1 (г) + Вr 2(ж) .
Не производя расчетов, определите знак ∆S ° 298 реакций.
42. При 25°С энтропия ромбической серы равна 31,98 Дж/моль×К, а энтропия моноклинической серы = 32,59 Дж/моль×К. Энтальпии сгорания ромбической и моноклинической серы соответственно равны -297,32 и - 297,57 кДж/моль. Определить ∆G ° 298 хр:
S (ромб) = S (монокл). Какая модификация серы более устойчива при данной температуре?
43. Определить, может ли данная реакция протекать в прямом направлении при стандартных условиях
Fе 3 О 4(тв) + 4Н 2 (Г) = 3Fe (тв) + 4Н 2 О(г)?
44. Получение синтез - газа (смесь оксида углерода (IV) и водорода) осуществляется по реакции СH 4(г) + Н 2 О (г) = СО (г) + ЗН 2 (г) . Определите:
а) экзо- или эндотермической является данная реакция;
б) увеличивается или уменьшается энтропия в ходе реакции;
в) в каком направлении самопроизвольно идет реакция в стандартных условиях?
45. В каком направлении будет самопроизвольно протекать реакция 2NO 2(г) = N 2 O 4(г) в стандартных условиях и при
температуре +227°С? Какой фактор, энтальпийный или энтропийный, будет определяющим при низких и высоких температурах?
46. В каком направлении будет самопроизвольно протекать данная реакция при температуре +1027°С?
СО (г) + Н 2 О (г) = СО 2 (г) + Н 2(г) .
Какой фактор, энтальпийный или энтропийный, будет определяющим при низких и высоких температурах?
48. Рассчитать, при какой температуре начинается реакция крекинга н-бутана по реакции С 4 Н 10 (г) = С 2 Н 6 (г) + С 2 Н 4 (г) . Энтальпийный или энтропийный фактор является определяющим при низких и высоких температурах?
49. На основании термодинамических данных для реакции
6С (графит) + 6Н 2(г) = С 6 Н 12 (г) определить:
а) в каком направлении самопроизвольно будет протекать эта реакция при температуре 298 К?
б) энтальпийный пли энтропийный фактор будет определяющим в этих условиях?
в) нагревание или охлаждение будет способствовать более полному протеканию прямой реакции?
50. По табличными значениям термодинамических величин участников следующих реакций
С (графит) + 2Н 2(г) = СН 4 (г) ,
2С (графит) + 2Н 2(г) = С 2 Н 4 (г) ,
2С (графит) + Н 2(г) = С 2 Н 2 (г) ,
определить:
а) какой из углеводородов можно получить синтезом из простых веществ при стандартных условиях;
б) какой из углеводородов можно синтезировать при повышенной температуре;
в) какой из углеводородов наиболее стоек к разложению при 298 К?
51. Написать уравнения реакций получения углеводородов:
СН 4(г) , С 2 Н 6(г) , С 3 Н 8(г) , С 4 Н 10(г) , С 5 Н 12(г) и С 6 Н 14(г) из простых веществ
(графит и водород) и по табличными значениям термодинамических величин ответить на вопросы:
а) возможен ли синтез этих веществ при стандартных условиях?
б) как изменяется устойчивость углеводородов в этом ряду?
в) в какой из реакций изменение энтропии будет наибольшим?
г) как повлияет увеличение температуры на возможность получения этих веществ?
52. Будет ли химически устойчива смесь сероводорода и кислорода при t = 25 °C и парциальных давлениях газов, равных 1 атм, если взаимодействие возможно по реакции:
2H 2 S (г) + О 2(г) = 2Н 2 О (г) + 2S (ромб) ?
53. Рассчитать температуру, при которой окислительная способность кислорода и хлора будет одинакова 4НС1 (г) + О 2(г) = 2Н 2 О (г) + 2C1 2(г). Какой из газов (О 2 или С1 2) будет проявлять более сильные окислительные свойства при низких температурах? Энтальпийный или энтропийный фактор будет определяющим при высоких и низких температурах?
54. На основании термодинамических данных реакции
ZnO (тв) + С (графит) = Zn + СО (г) определить:
а) возможно ли осуществить восстановление ZnO при стандартных условиях?
б) повышение или понижение температуры будет способствовать более глубокому протеканию данной реакции?
в) при какой температуре восстановительная активность Znи С (графит) будет одинакова?
г) чем обусловлено изменение энтропии в ходе реакции?
55. По табличным значениям термодинамических величин рассчитать температуру, при которой начинается пиролиз метана по реакции:
2СН 4(г) = С 2 H 4(г) +2 H 2(г) .
Какой из факторов, энтальпийный или энтропийный, является определяющим в направлении протекания данной реакции при низких и высоких температурах?
56. Для реакций:
ZnS (тв) + 2НС1 (ж) = H 2 S (г) + ZnCl 2(p) , ∆G ° 298 хр = -462,6 кДж,
РbS (тв) + 2НС1 (ж) = H 2 S (г) + РbС1 2(р) , ∆G ° 298 хр = +31,0 кДж.
указать, какой из сульфидов можно растворить в разбавленной соляной кислоте.
57. На основании следующих данных:
P (белый) + 3/2Сl 2(г) = PСl 3(г), ∆G ° 298 хр = -286,68 кДж,
P (белый) + 5/2С1 2 (г) = РС1 5 (г) , ∆G ° 298 хр = -325,10 кДж.
ответить на вопросы:
а) можно ли синтезировать хлориды фосфора из простых веществ при стандартных условиях?
6) повышение или понижение температуры будет способствовать более глубокому протеканию реакций?
в) какой из хлоридов фосфора более устойчив к разложению?
58. Исходя из значений ∆G ° 298 хр для следующих реакций:
Fe(OH) 2(тв) + l/4O 2(г) + 1/2Н 2 О (ж) =Fе(ОН) 3 (тв) , ∆G ° 298 хр = -92,18кДж,
Со(ОН) 2 (тв) +1/4О 2(г) + 1/2Н 2 О (ж) = Со(ОН) 3(тв) , ∆G ° 298 =-23,68 кДж,
Ni(ОН) 2 (тв) + 1/4О 2(г) + 1/2Н 2 О (ж) =Ni(ОН) 3(тв) , ∆G ° 298 = +22,88 кДж
определить:
а) какой из гидроксидов (II) или (III) каждого из элементов более устойчив при стандартных условиях;
б) какой из гидроксидов (III) обладает большей устойчивостью при ст. усл.;
в) какой из гидроксидов (II) наиболее устойчив к окислению;
г) какая степень окисления (+2 или +3) более характерна для Fe,Co, Ni при ст. усл?
59. На основании имеющихся данных:
С (графит) +2F 2(г) = СF 4(г) , ∆G ° 298 хр = -636,04 кДж,
С (графит) +2 Cl 2(г) = СCl 4(г) , ∆G ° 298 хр = -60,63 кДж,
С (графит) +2 Br 2(ж) = CBr 4(г) , ∆G ° 298 хр = 66,94 кДж,
С (графит) + 2I 2(тв) = СI 4(г) ∆G ° 298 хр = 124,86 кДж,
определить: а) возможность получения тетрагалидов углерода из простых веществ при ст.усл.; б) изменение степени сродства галогенов к углероду; в) какой из тетрагалидов наиболее устойчив при ст.усл.
60. Напишите уравнения реакций, соответствующих табличным значениям ∆G ° 298 обр гидридов (Н 2 Э) элементов VI группы (О, S, Se, Те) и сделайте следующие выводы:
а) как изменяется химическая активность этих элементов по отношению к водороду;
б) возможен ли синтез данных гидридов из простых веществ при ст. усл.;
в) в какой из этих реакций изменение энтропии будет наибольшим?
61. Напишите уравнения реакций, соответствующих табличным значениям ∆G ° 298 обр галогенводородов и сделайте следующие выводы:
а) возможен ли синтез данных соединений из простых веществ при ст. усл.;
б) как изменяется относительная устойчивость галогенводородов при ст.усл.;
в) какой из галогенов проявляет наиболее сильные окислительные свойства и какой из галогенводородов - восстановительные;
г) в какой из реакций изменение энтропии будет наибольшим?
62. На основании следующих данных для оксидов элементов VI(В) группы
СrО 3 МоО 3 WO 3
∆G ° 298обр, кДж/моль -507 -679 -763
сделайте вывод, как изменяется устойчивость высших оксидов указанных элементов при ст.усл.?
63. На основании следующих данных для соединений Мn, Тс, Re
Мn 2 О 7 Тс 2 О 7 Re 2 O 7
∆G ° 298 обр, кДж/ моль -545 -939 -1068
сделайте вывод об относительной устойчивости высших оксидов d - элементов VII группы.
64. Для реакций НClО (р) =НCl (р) +1/20 2(г) , ∆G ° 298 = -51,5 кДж,
НВrО (р) =НВr (р) +1/20 2(г) , ∆G ° 298 =-21,8кДж,
НIO (р) =НI (р) +1/20 2(г) , ∆G ° 298 = + 47,8кДж указать: а)какая из кислот будет наиболее устойчивой?
65.Определить, какой из оксидов, СО 2 , N 2 O 5 или SO 3 , в большей степени проявляет кислотные свойства:
G ° 298 хр = -134,0 кДж,
СаО (тв) + N 2 O 5(г) =Ca(NO 3) 2 (тв) ∆G ° 298 хр = -272,0 кДж,
СаО (тв) + SO 3(г) = CaSO 4(тв) , ∆G ° 298 хр = -348,0 кДж.
66. Какой из оксидов, Na 2 O, CaO или MgO, проявляет более сильные основные свойства:
СаО (тв) + СО 2(г) = СаСО 3(тв) , ∆G ° 298 хр = -134,0 кДж,
MgO (тв) +CO 2 (г) =MgCO 3 (тв) , ∆G ° 298 хр = -67,0 кДж,
Na 2 O (тв) +CO 2 (г) =Na 2 CO 3(тв) , ∆G ° 298 хр = -277,0 кДж
67. Для реакций:
Al 2 O 3(тв) + 3SO 3(г) = Al 2 (SO 4) 3(тв) , ∆G
° 298 хр = -380,5кДж,
ZnO (тв) + SO 3(г) = ZnSO 4(тв) , ∆G
° 298 хр = -188,5 кДж
указать, какой из оксидов проявляет более сильные основные свойства
68. На основании реакций:
А1 2 О 3(тв) + 3SO 3(г) = Al 2 (SO 4) 3(тв) , ∆G ° 298 хр = -380,5кДж,
А1 2 О 3(тв) + Na 2 O (тв) = 2NaAlO 2(тв) , ∆G ° 298 хр = -199,0 кДж указать:
а) характер А1 2 О 3 (основной, амфотерный или кислотный);
б) какой характер (кислотный или основной) выражен ярче?
69.Исходя из значения ∆G
2Rb (тв) +1/2О 2(г) = Rb 2 О (тв) ,
2Ag (тв) +1/2О 2(г) =Ag 2 О (тв) ,
а) рубидий или серебро имеет большее сродство к кислороду;
б) какой из оксидов является более устойчивым?
70. Исходя из значения ∆G ° 298 для следующих процессов:
GeO 2(тв) + Ge (тв) = 2GeO (тв) , ∆G ° 298 хр = 41,9 кДж,
SnO 2(тв) + Sn (тв) = 2SnO (тв) , ∆G ° 298 хр = 6,3кДж,
РbО 2(тв) + Рb (тв) = 2РbО (тв) , ∆G ° 298 хр = -158,8 кДж, указать:
а) возможность протекания реакций в прямом направлении;
б) наиболее характерную степень окисления данных элементов.
71. На основании следующих данных:
Рb (тв) + F 2(г) = PbF 2(тв) , ∆G ° 298 хр = -620,5 кДж,
Рb (тв) + С1 2(г) = РbС1 2(тв) , ∆G ° 298 хр = -314,4 кДж,
Рb (тв) + Вr 2(ж) = РbВr 2(тв) , ∆G ° 298 хр = -260,78 кДж,
Рb (тв) +I 2(тв) = РbI 2(тв) , ∆G ° 298 хр = -174,01 кДж
ответить на следующие вопросы:
а) возможно ли синтезировать галиды свинца из простых веществ?
б) какой из галогенов проявляет наиболее сильные окислительные свойства?
в) какой из галидов обладает наибольшей устойчивостью к разложению?
г) в какой из реакций изменение энтропии будет наименьшим?
72. Даны ∆G
° 298 o6 p (кДж/моль) галидов калия и меди:
КF (тв) -534,2 CuF (тв) - 231,3
КС1 (тв) -408,5 CuCl (тв) -119,4
КВr (тв) -379,6 CuBr (тв) -102,2
KI (тв) - 322,6 CuI (тв) -71,2
Написать уравнения реакций образования галидов, соответствую-щие этим значениям, и сделать следующие выводы для ст.усл.:
а) можно ли синтезировать данные галиды из простых веществ?
б) как изменяется относительная устойчивость галидов калия и меди?
в) калий или медь обладают более сильными восстановительными свойствами?
г) какой из галогенов обладает более сильными окислительными свойствами?
д) какой из галидов обладает более сильными восстановительными свойствами?
73. На основании следующих данных:
Mg (тв) + 1/2О 2(г) + Н 2 О (ж) = Mg(OH) 2(тв) , ∆G ° 298 хр = -598 кДж,
Сu (тв) +1/2О 2(г) + Н 2 О (ж) = Сu(ОН) 2(тв) , ∆G ° 298 хр = -120 кДж,
Аu (тв) + 3/4О 2 (г) +3/2Н 2 О (ж) = Аu(ОН) 3(тв) , ∆G ° 298 хр = 66 кДж
определить:
а) какие из металлов способны окисляться при стандартных условиях?
б) какой из гидроксидов обладает наибольшей устойчивостью?
в) какой из металлов является наиболее сильным восстановителем?
74. Пересчитайте ∆G ° 298 хр на 1 эквивалент оксида:
Na 2 O (тв) +Н 2 О (ж) = NaOH (тв) , ∆G ° 298 хр = -147,61 кДж,
MgO (тв) + H 2 O (ж) = Mg(OH) 2(тв), ∆G ° 298 хр = -27,15 кДж,
А1 2 О 3(тв) + ЗН 2 О (ж) = 2А1(ОН) 3(тв) , ∆G ° 298 хр = 18,27 кДж
и определите, какой из оксидов имеет наиболее сильные основные свойства.
75. Даны ∆G ° 298 o6 p йодидов металлов:
NaI MgI 2 А1I 3
∆G ° 298 o6 p (кДж/моль) -285 -360 -314
Напишите уравнения реакций образования иодидов, пересчитайте ∆G ° 298 обр на 1 эквивалент соединения и сделайте следующие выводы:
а) как изменяется устойчивость иодидов к нагреванию в данном ряду;
б) как изменяется восстановительная активность соответствующих им металлов?
76. Даны ∆G ° 298 o6 p соединений р - элементов V группы с водородом
∆G ° 298 o6 p (кДж /моль) -17 13,39 156
Напишите уравнения реакций образования соединений, соответствующих этим величинам, и сделайте следующие выводы:
а) как изменяется устойчивость данных соединений;
б) как изменяется окислительная способность данных р - элементов;
в) как изменяется в этом ряду восстановительная способность соединений?
77. Даны ∆G ° 298 o6 p соединений неметаллов
PH 3(г) H 2 S (г) НС1 (г)
∆G ° 298 o6 p (кДж /моль) 13,39 -34 -96
Напишите уравнения реакций образования этих соединений и сделайте вывод: как изменяется устойчивость данных водородных соединений?
78. Изменение энтропии при плавлении 1 моль СН 3 СООН равно
40,2 Дж/моль×К. Температура плавления кислоты равна 16,6°С. Рассчитать теплоту плавления в Дж/г и в Дж/моль.
79. От лития к азоту энтропия меняется следующим образом:
Li (тв) Be (тв) B (тв) C (алмаз) N 2(г)
S ° 298 (Дж/моль∙К) 28,07 9,55 5,87 2,83 191,5
d , г/см 3 при 20°С 0,534 1,848 2,340 3,515 -
Объясните, почему энтропия сначала уменьшается, а у азота резко возрастает?
80. Чему равно изменение энтропии (S ° 298) при следующих фазовых переходах:
а) при плавлении 1 моля бензола С 6 Н 6 , если t пл = 5,49°С, а ∆Н ° пл = 126,54 Дж/г?
б) при плавлении 1 моля алюминия в точке плавления при t пл = = 660°С, если ∆Н ° пл = 10,43 кДж/молъ?
в) при испарении 2 молей хлористого этила C 2 H 5 CI, если t кип = = 14,5°С, а ∆Н ° исп = 377,1 Дж/г?
г) при испарении 2 молей жидкого кислорода в точке кипения, если
t кип = -I93°C, a ∆Н ° исп = 6829,7 Дж/моль?
д) при испарении 1,1 моля воды при 25°С, если мольная теплота испарения при этой температуре ∆Н ° исп = 44,08 кДж/моль?
е) при переходе 1г кварца (SiO 2) из β - в α-модификацию при t = 573°C, если ∆Н ° перехода равно 7,54 кДж/моль?;
ж) при плавлении 1 моля сурьмы, если t пл = 630°С, а ∆Н ° пл = =20,11 кДж/моль?
з) при плавлении 100 г хлорида натрия, при t
= 800 °C, если ∆Н
° пл = 30251 Дж/моль?
и) при плавлении 1 моля льда, при t
° плавления, если ∆Н
° пл = = 335,2 Дж/г?
к) при плавлении 0,05 кг свинца, если t пл =327,4°C, а ∆Н ° пл = =23,04 Дж/г?
л) при испарении 1000 г воды при 25°С, если мольная теплота испарения при этой температуре ∆Н ° исп = 44,08 кДж/молъ?
82. Теплота испарения бромбензола при Т = 429,8 К равна 241 Дж/г. Определить ∆S ° при испарении 1,25 моля бромбензола.
83. Изменение энтропии при плавлении 100 г меди равно 1,28 Дж/К. Рассчитать удельную теплоту плавления меди, если температура ее плавления равна 1083°С.
ЛАБОРАТОРНЫЕ РАБОТЫ ПО ТЕМЕ "ТЕРМОХИМИЯ"
Предсказание возможности осуществления той или иной реакции - одна из основных задач, стоящих перед химиками. На бумаге можно написать уравнение любой химической реакции («бумага все стерпит»). А можно ли практически осуществить такую реакцию?
В одних случаях (например, при обжиге известняка: СаСO 3 = СаО + СO 2 - Q) достаточно повысить температуру чтобы реакция началась, а в других (например, при восстановлении кальция из его оксида водородом: СаО + Н 2 → Са + Н 2 O) - реакцию невозможно осуществить ни при каких условиях!
Экспериментальная проверка возможности протекания той или иной реакции в разных условиях - дело трудоемкое и неэффективное. Но можно теоретически ответить на такой вопрос, основываясь на законах химической термодинамики - науки о направлениях химических процессов.
Один из наиболее важных законов природы (первый закон термодинамики) - это закон сохранения энергии:
В общем случае энергия объекта складывается из трех ее основных видов: кинетической, потенциальной, внутренней. Какой из этих видов наиболее важен при рассмотрении химических реакций? Конечно же внутренняя энергия (Е)\ Ведь она складывается из кинетической энергии движения атомов, молекул, ионов; из энергии их взаимного притяжения и отталкивания; из энергии, связанной с движением электронов в атоме, их притяжением к ядру, взаимным отталкиванием электронов и ядер, а также внутриядерной энергии.
Вам известно, что при химических реакциях одни химические связи разрушаются, а другие образуются; при этом изменяется электронное состояние атомов, их взаимоположение, а потому и внутренняя энергия продуктов реакции отличается от внутренней энергии реагентов.
Рассмотрим два возможных случая.
1. Е реагентов > Е продуктов. Исходя из закона сохранения энергии, в результате такой реакции энергия должна выделяться в окружающую среду: нагревается воздух, пробирка, автомобильный двигатель, продукты реакции.
Реакции, при которых выделяется энергия и нагревается окружающая среда, называют, как вы знаете, экзотермическими (рис. 23).
Рис. 23.
Горение метана (а) и диаграмма изменения внутренней энергии веществ в этом процессе (б)
2. Е реагентов меньше Е продуктов. Исходя из закона сохранения энергии, следует предположить, что исходные вещества при таких процессах должны поглощать энергию из окружающей среды, температура реагирующей системы должна понижаться (рис. 24).

Рис. 24.
Диаграмма изменения внутренней энергии веществ при разложении карбоната кальция
Реакции, при протекании которых энергия поглощается из окружающей среды, называют эндотермическими (рис. 25).

Рис. 25.
Процесс фотосинтеза - пример эндотермической реакции, происходящей в природе
Энергия, которая выделяется или поглощается в химической реакции, называется, как вы знаете, тепловым эффектом этой реакции. Этот термин используют повсеместно, хотя точнее было бы говорить об энергетическом эффекте реакции.
Тепловой эффект реакции выражается в единицах энергии. Энергия отдельных атомов и молекул - величина незначительная. Поэтому тепловые эффекты реакций относят обычно к тем количествам веществ, которые определены уравнением, и выражают в Дж или кДж.
Уравнение химической реакции, в котором указан тепловой эффект, называют термохимическим уравнением.
Например, термохимическое уравнение:
2Н 2 + O 2 = 2Н 2 O + 484 кДж.
Знание тепловых эффектов химических реакций имеет большое практическое значение. Например, при проектировании химического реактора важно предусмотреть или приток энергии для поддержания реакции путем подогрева реактора, или, наоборот, отвод избытка теплоты, чтобы не было перегрева реактора со всеми вытекающими отсюда последствиями, вплоть до взрыва.
Если реакция проходит между несложными молекулами, то подсчитать тепловой эффект реакции достаточно просто.
Например:
Н 2 + Сl 2 = 2НСl.
Энергия затрачивается на разрыв двух химических связей Н-Н и Cl-Сl, энергия выделяется при образовании двух химических связей Н-Сl. Именно в химических связях сосредоточена важнейшая составляющая внутренней энергии соединения. Зная энергии этих связей, можно по разности узнать тепловой эффект реакции (Q p).

Следовательно, данная химическая реакция - экзотермическая.
А как, например, рассчитать тепловой эффект реакции разложения карбоната кальция? Ведь это соединение немолекулярного строения. Как точно определить, какие именно связи и сколько их разрушается, какова их энергия, какие связи и сколько их образуется в оксиде кальция?
Для расчета тепловых эффектов реакций используют значения величин теплот образования всех участвующих в реакции химических соединений (исходных веществ и продуктов реакции).
При этих условиях теплота образования простых веществ равна нулю по определению.
С + O 2 = СO 2 + 394 кДж,
0,5N 2 + 0,5O 2 = NO - 90 кДж,
где 394 кДж и -90 кДж - теплоты образования СO 2 и NO соответственно.
Если данное химическое соединение можно непосредственно получить из простых веществ, причем реакция идет количественно (100%-й выход продуктов), достаточно провести реакцию и измерить ее тепловой эффект с помощью специального прибора - калориметра. Так определяют теплоты образования многих оксидов, хлоридов, сульфидов и т. п. Однако подавляющее большинство химических соединений трудно или невозможно непосредственно получить из простых веществ.
Например, сжигая уголь в кислороде, нельзя определить Q обр угарного газа СО, так как всегда идет и процесс полного окисления с образованием углекислого газа СO 2 . В этом случае на помощь приходит закон, сформулированный в 1840 г. российским академиком Г. И. Гессом.

Знание теплот образования соединений позволяет оценить их относительную устойчивость, а также рассчитать тепловые эффекты реакций, используя следствие из закона Гесса.
Тепловой эффект химической реакции равен сумме теплот образования всех продуктов реакции минус сумма теплот образования всех реагентов (с учетом коэффициентов в уравнении реакции):
Например, требуется вычислить тепловой эффект реакции, уравнение которой
Fe 2 O 3 + 2Аl = 2Fe + Al 2 O 3 .
В справочнике найдем значения:
Q oбp (Аl 2 O 3) = 1670 кДж/моль,
Q o6p (Fe 2 O 3) = 820 кДж/моль.
Теплоты образования простых веществ равны нулю. Отсюда
Q p = Q обр (Аl 2 O 3) - Q обр (Fe 2 O 3) = 1670 - 820 = 850 КДЖ.
Тепловой эффект реакции
Fe 2 O 3 + ЗСО = 2Fe + ЗСO 2
вычисляется так:
Тепловой эффект реакции выражают и по-другому, используя понятие «энтальпия» (обозначают буквой Н).
Многие процессы протекают без подвода энергии от внешнего источника. Такие процессы называют самопроизвольными .
Примерами самопроизвольных процессов могут служить падение камня с высоты, течение воды под уклон, переход теплоты от более нагретого тела к менее нагретому.
Человеческий опыт показал, что самопроизвольные процессы в обратном направлении не могут протекать самопроизвольно, т.е. самопроизвольно не потечет вода в гору, камень не полетит вверх, а теплота не перейдет от холодного тела к нагретому.
(хотя с точки зрения первого закона термодинамики, одинаково правдоподобны как процесс перехода тепла от горячего тела к холодному, так и обратный процесс, т.е. переход от тепла от холодного тела к горячему, ибо и в том и в другом случаях соблюдается закон сохранения и превращения энергии)
Многие химические реакции также протекают самопроизвольно, например , образование ржавчины на металлах, реакция натрия с водой, растворение соли в воде и др.
Чтобы понимать химические процессы и управлять ими, необходимо знать ответ на вопрос: каковы движущие силы и критерии самопроизвольных процессов?
Одной из движущих сил химической реакции является рассмотренное нами ранее уменьшение энтальпии системы, т.е. экзотермический тепловой эффект реакц ии.
Как показывает опыт, большинство экзотермических реакций (?Н <0) протекают самопроизвольно. – Почему?
Однако условие?Н <0 не может быть критерием! Самопроизвольного течения реакций, так как существуют самопроизвольные эндотермические химические реакции, у которых?Н >0, например, взаимодействие метана с водяным паром при высокой температуре.
Следовательно, кроме уменьшение энтальпии системы (энтальпийного фактора) имеется другая движущая сила самопроизвольного процесса.
Такой силой является стремление частиц (молекул, ионов, атомов) к хаотичному движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному.
Например, представим пространство, в которое помещено вещество, в виде шахматной доски, а само вещество – в виде зерен. Каждая клетка доски соответствует определенному положению и уровню энергии частиц. Если частицы распределяются по всему пространству, то вещество находится в газовом состоянии; если частицы займут только небольшую часть пространства, то вещество перейдет в конденсированное состояние. Все высыпанные зерна распределяются на доске более или менее равномерно. На каждой клетке доски окажется определенное число зерен. Положение зерен после каждого рассыпания соответствует микросостоянию системы, которое можно определить как мгновенный снимок, фиксирующий расположение частиц в пространстве. Каждый раз мы получаем систему в одном и том же макросостоянии. Число подобных микросостояний, удовлетворяющих ожидаемому макросостоянию (при достаточно большом количестве частиц) очень велико.
Например , коробка с ячейками, в которой находятся шары: так в 9 ячейках находятся 4 шара – это модель макросистемы . Шары по ячейкам можно разложить 126 различными способами, каждый из которых является микросостоянием.
Число микросостояний, посредством которых реализуется данное макро состояние, связано с термодинамической вероятностью W . Энтропия определяется термодинамической вероятностью : она тем выше, чем больше способов реализации макросостояния .
Поэтому считают, что энтропия – мера неупорядоченности системы.
Математически связь энтропии с числом микросостояний установил Л. Больцман в конце 19 века, выразив ее уравнением:
S = k * ln W ,
где W - термодинамическая вероятность данного состояния системы при определенном запасе внутренней энергии U и объеме V ;
k – постоянная Больцмана, равная 1,38*10 -23 Дж/К.
Пример с шарами, конечно, очень нагляден, но он коварен, так как на основании его интуитивно под упорядоченностью системы иногда понимают расположение частиц в пространстве .
Однако, в действительности под термодинамическим состоянием подразумевается, главным образом, расположение частиц (например, молекул) по возможным уровням энергии (каждый вид движения –колебательное, вращательное, поступательное- характеризуется своим уровнем энергии).
Энтропия также зависит от массы частиц и их геометрического строения.
Кристаллы имеют
наименьшую энтропию (так их частицы могут колебаться только около некоторого
состояния равновесия), а газы – наибольшую, так как для их частиц возможны все
три вида движения. S T
Всякому веществу можно приписать определенное абсолютное значение энтропии.
Конечно, энтропии веществ обычно не рассчитывают на основании уравнения Больцмана. Их определяют по уравнению классической термодинамики с учетом теплоемкости данного вещества и теплот фазовых переходов.
Значение энтропии различных веществ при 298 К и давлении 1 атм. (S 0 298) являются табличными данными.
На основании данных о стандартной энтропии веществ можно рассчитать изменение энтропии различных химических процессов. Поскольку энтропия является функцией состояния , то ее изменение не зависит от пути процесса и равно разности энтропий продуктов реакций и исходных веществ:
?S 0 реакц .= ? ? i S 0 - ? ? jS 0
Во многих случаях изменение энтропии процесса можно оценить качественно:
· Так, энтропия всегда увеличивается при переходе из конденсированного состояния (твердого или жидкого) в парообразное.
· Энтропия всегда возрастает при растворении твердого или жидкого вещества, причем, чем больше степень диссоциации, тем заметнее увеличивается энтропия. При растворении газов, напротив, энтропия уменьшается.
· Чем сложнее состав вещества, тем больше энтропия. Например, для оксидов марганца МnO , Mn 2 O 3, Mn 3 O 4 энтропия равна соответственно 61,50; 110,5; 154,8 кДЖ/моль*К.
· В химических реакциях энтропия возрастает, если в результате их увеличивается количество газообразных веществ. Например, в реакции термического разложения карбоната кальция:
СаСО 3(т) = СаО (т) + СО 2(г)
Второе начало (закон) термодинамики регламентирует принципиальную возможность протекания различных процессов. В середине 19 века этот закон был сформулирован в виде нескольких постулатов. Наиболее известные из них следующие:
· Невозможно осуществить перенос тепла от более холодного тела к более горячему, не затрачивая на это работу .
(Р. Клаузиус)
и с использованием понятия энтропии:
· В изолированных системах самопроизвольно идут процессы, при которых происходит увеличение энтропии. (? S изолир. >0)
Всякая изолированная система самопроизвольно стремиться принять состояние, характеризующееся максимальной термодинамической вероятностью.
На основании уравнения Больцмана можно показать, что любой необратимый процесс, самопроизвольно протекающий в изолированной системе, характеризуется увеличением энтропии. Пусть в изолированной системе находятся два химически не взаимодействующих газа, например гелий и неон, при одинаковых условиях, разделенные перегородкой. В этом состоянии термодинамическая вероятность системы w 1 . При удалении перегородки газы начинают самопроизвольно диффундировать друг в друга до тех пор, пока молекулы каждого газа равномерно не распределятся по всему объему. В конечном состоянии термодинамическая вероятность w 2 . Система самопроизвольно перешла из менее вероятного состояния в более вероятное (w 2 > w 1). Энергетический обмен системы с внешней средой отсутствует, следовательно, единственная причина протекания этого процесса - увеличение энтропии.
Другими словами, процессы протекают самопроизвольно лишь в сторону менее упорядоченного состояния, т.е. нарастания беспорядка. Именно поэтому испарение жидкости, растворение соли в воде или смешение газов происходит самопроизвольно, а вместе с тем обратные процессы без обмена энергией с окружающей средой невозможны.
Следовательно, увеличение энтропии является критерием самопроизвольного протекания процессов только в изолированных системах, т.е. не обменивающихся энергией с внешней средой, а это довольно редкий случай. В открытых и замкнутых системах, кроме изменения энтропии, на направление процесса влияет еще и изменение энтальпии.
Вопрос 5. Энергия Гиббса и Гельмгольца. Критерий самопроизвольного протекания процессов.
Какие же процессы идут самопроизвольно в неизолированных системах? При взаимодействии водорода с кислородом самопроизвольно образуется вода:
2Н 2(г) +О 2(г) = 2Н 2 О (г)
В этой реакции энтропия уменьшается, но выделяется большое количество теплоты (? S <0, ?Н <0), т.е. самопроизвольному протеканию процесса способствует уменьшение энтальпии.
Самопроизвольно происходит и растворение хлорида аммония в воде:
NH 4 Cl (тв) + aq = NH 4 + (р) + Cl - (р)
Этот процесс сопровождается понижением температуры (поглощение теплоты) и увеличением энтропии (? S > 0, ?Н > 0), причем главную роль играет последний фактор.
В термодинамике вводится новая функция, связывающая две предыдущие величины – энергия Гиббса.(G )
G = H – TS
Основная ценность этой функции заключается в том, что ее изменение при постоянной температуре и давлении определяет самопроизвольность процессов.
? G = ( ? H – T ? S ) <0
· В классической термодинамике под энтропией понимают такое свойство системы, изменение которого при обратимом процессе численно равно отношению теплоты к температуре протекания процесса:
? S = Q/T ; T ? S=Q
· В термодинамике обратимым называют такой процесс, который проводится бесконечно медленно и так, чтобы система находилась все время практически в состоянии равновесия.
Таким образом, величина ? G характеризует ту часть изменения внутренней энергии, которая может быть превращена в полезную работу.
При условии постоянства объема пользуются термодинамической функцией, которая называется Энергией Гельмгольца (F ):
F = U – T ? S
В изохорном процессе полезная работа определяется изменением энергии Гельмгольца, а условием самопроизвольности процесса является ее уменьшение ? F <0.
В химии обычно пользуются энергией Гиббса, поскольку чаще всего химические реакции проводят при постоянном (атмосферном) давлении.
Итак, в неизолированной системе процесс преимущественно происходит самопроизвольно, если ему соответствует уменьшение энергии Гиббса. (? G <0.)
При ? G =0 состояние системы соответствует равновесию.
При ? G > 0 -процесс преимущественно не протекает в прямом направлении
Анализ уравнения ? G =( ? H – T ? S ) показывает, что знак величины ? G , а значит, термодинамическая возможность самопроизвольного протекания реакции зависят от двух факторов: энтальпийного (энергетического) и энтропийного . С одной стороны, система стремится занять прийти к минимальному уровню энергии, выделив часть ее в виде теплоты или работы (? H <0). С другой стороны, система стремится занять наиболее вероятное состояние, характеризующееся максимумом молекулярного беспорядка, т.е. максимумом энтропии (? S >0). В этом случае энтальпийный и энтропийный факторы действуют в направлении, благоприятствующему протеканию реакции.
Рассмотрим варианты:
а) ? H <0; ? S >0; в этом случае? G <0 при всех значениях температуры, процесс термодинамически возможен при любой температуре.
б) ? H <0; ? S <0; в этом случае? G <0 при Т< , т.е. при реакция термодинамически возможна при при сравнительно низкотемпературном режиме;
в) ? H >0; ? S >0; в этом случае? G <0 при Т> , процесс возможен при высоких температурах;
г) ? H >0; ? S <0; в этом случае? G <0 - оба фактора действуют в неблагоприятном направлении, реакция термодинамически невозможна при любых значениях температур.
Первый способ расчета аналогичен методу оценки изменения энтальпии реакции по табулированным энтальпиям образования различных веществ. В таблицах сведены и величины ? G 0 обр.298 и точно также принято, что для простых веществ ? G 0 обр.298 =0
? G 0 реакц. = ?? i ? G 0 обр.прод. - ?? j ? G 0 обр.исх.
i j
Второй способ основан на расчете сначала величин ? H реакц.. и ? S реакц. для данного процесса, а потом исходя из них – величины ? G 0 реакц по формуле:
? G 0 реакц = ? H 0 реакц. – 298 ? S 0 реакц.
Данный способ хорош тем, что позволяет оценить, как изменится знак ? G 0 реакц при изменении температуры.
Хотя энтальпия и энтропия веществ зависят от температуры, но для реакции изменение этих величин незначительно, поэтому приближенно считают, что в некотором интервале температур ? H реакц.. и ? S реакц величины практически постоянные.
Для простых веществ, находящихся в термодинамически устойчивых состояниях ? G 0 =0.
Свободная энергия Гиббса (или просто энергия Гиббса , или потенциал Гиббса , или термодинамический потенциал в узком смысле) - это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции.
аправление протекания химической реакции определяет энергия Гиббса (∆G). Еще энергию Гиббса называют изобарно - изотермическим потенциалом. Размерность энергии Гиббса кДж/моль.
При постоянном давлении и температуре (р=const, T=cons)t реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса. Если ∆G < 0, то реакциясамопроизвольно протекает в прямом направлении. Если ∆G > 0, то самопроизвольное протекание процесса в прямом направлении в данных условиях невозможно, а возможно протекание обратного процесса. Если ∆G = 0, то реакция может протекать как в прямом направлении, так и в обратном, и система находится в состоянии равновесия.
Изменение энергии Гиббса в ходе химической реакции (∆ ) не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакцииравно сумме энергий Гиббса продуктов реакции за вычетом суммы энергий Гиббса исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энергия Гиббса реакции
aA + bB = сС + dD
где ∆G 0 – стандартная энергия Гиббса образования вещества, кДж/моль.
Энергия Гиббса образования простых веществ равна нулю. ∆ имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в кДж.
Изменение стандартной энергии Гиббса химической реакции может быть также вычислено по уравнению:
∆ = ∆ – Т∆ , где
Т – абсолютная температура,
∆ – изменениеэнтропии.
∆H х.р. – изменениеэнтальпии.
При химическом взаимодействии одновременно изменяется энтальпия, характеризующая теплосодержание системы, и энтропия, характеризующая стремление системы к беспорядку. Уменьшение энтальпии и рост энтропии - две движущих силы любого химического процесса. В состоянии равновесия ∆ =0, значит:
∆ – Т∆ =0 и
Если пренебречь изменениями ∆H 0 х.р. и ∆S 0 х.р с увеличением температуры, то можно определить температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов:
Т равн. =
Многие химические реакции протекают самопроизвольно, т.е. без затрат энергии извне. Одной из движущих сил самопроизвольного химического процесса является уменьшение энтальпии системы, т.е. экзотермический тепловой эффект реакции. Другой – стремление частиц (молекул, ионов, атомов) к хаотическому движению, беспорядку. Мерой хаотичности, неупорядоченности состояния системы служит термодинамическая функция, называемая энтропией (S).
При переходе системы из более упорядоченного состояния в менее упорядоченное состояние (нагревание, испарение, плавление) энтропия возрастает (DS>0). В случае перехода системы из менее упорядоченного состояния в более упорядоченное (охлаждение, конденсация, кристаллизация) энтропия системы уменьшается (DS<0).
В изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии (S>0) – это суть второго закона термодинамики.
Энтропия вещества в стандартном состоянии называется стандартной энтропией (So) и имеет единицу измерения Дж/моль К
Энтропия вещества в газообразном состоянии существенно выше, чем в жидком и твердом состояниях, поэтому об изменении энтропии в химической реакции судят по изменению числа молей газообразных веществ.
Возможность самопроизвольного протекания химического процесса определяется двумя факторами:
Стремлением к образованию прочных связей между частицами, к возникновению более сложных веществ, что сопровождается понижением энергии системы – энтальпийный фактор (DH<0);
Стремлением к разъединению частиц, к беспорядку, что характеризуется возрастанием энтропии – энтропийный фактор (DS>0).
Эти факторы объединяет функция, называемая энергией Гиббса (DG), равная: DG = DH - T DS. (D- это дельта типа, треугольник короче)
Изменение энергии Гиббса служит критерием самопроизвольного протекания химической реакции:
Химическая реакция принципиально возможна, если энергия Гиббса в ходе реакции уменьшается (DG<0);
Химическая реакция не может протекать самопроизвольно, если энергия Гиббса системы возрастает (DG>0), протекает обратная реакция;
Химическая реакция может протекать как в прямом, так и в обратном направлении, т.е. система находится в состоянии равновесия (DG=0).
Из уравнения DG=DH-T DS следует:
Если DН<0 и DS>0, то всегда DG<0, т.е. реакция с выделением теплоты и увеличением степени беспорядка возможна при любых температурах;
Если DH>0 и DS<0, то всегда DG>0, т.е. реакция с поглощением теплоты и увеличением степени порядка невозможна ни при каких условиях;
DH>0, DS<0. Реакция будет протекать в прямом направлении только при условии, что |T DS|>|DH|. Эти реакции протекают при высокой температуре;
DH<0, DS>0. Условие самопроизвольного протекания реакции: |DH|>|T DS|. Такие реакции идут обычно при низких температурах.
Температуру, при которой происходит смена знака энергии Гиббса реакции, можно определить из условия равновесия:
Тр = DH/DS, где Тр – температура, при которой устанавливается равновесие.
Изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых в стандартных условиях, называется стандартной энергией Гиббса образования вещества (DGof). Стандартная энергия Гиббса образования простых веществ принимается равной нулю.
Стандартную энергию Гиббса химической реакции (DGor) можно рассчитать как сумму стандартных энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов .
В предыдущих параграфах мы рассмотрели несколько примеров, показывающих, что при определенных условиях каждая химическая реакция самопроизвольно протекает в определенном направлении. Так, при низких температурах экзотермическая реакция образования парообразной воды
практически нацело протекает в прямом направлении. Но при высоких температурах эта реакция начинает идти в обратном направлении: водяной пар разлагается на водород и кислород. Во всех случаях в результате реакции может быть достигнуто состояние устойчивого химического равновесия, но само положение равновесия при разных условиях оказывается различным.
Возникает вопрос; в чем причина определенной направленности химических процессов, какие факторы обусловливают то или иное состояние химического равновесия?
Известно, что в механических системах устойчивое равновесие соответствует минимуму потенциальной энергии системы. Так, шарик самопроизвольно скатывается из положения а на наклонной поверхности (рис. 69), причем его потенциальная энергия переходит сначала в кинетическую энергию движения шарика как целого, а затем в энергию теплового движения молекул. В положении б шарик находится в равновесии.
Естественно предположить, что и химические процессы должны самопроизвольно протекать в направлении уменьшения внутренней энергии системы, т. е. в направлении, отвечающем положительному тепловому эффекту реакции. Действительно, опыт показывает, что при обычных условиях самопроизвольно протекают преимущественно экзотермические реакции.
Однако попытка объяснить направленность химических процессов только стремлением к минимуму внутренней энергии приводит к противоречиям с фактами.

Рис. 69. Шарик самопроизвольно скатывается из положения а в положение б.

Рис. 70. Сосуд, состоящий из дзух частей: в части А находится разреженный газ, в часта Б - вакуум.
Так, уже при обычных температурах самопроизвольно протекают эндотермические процессы растворения многих солей и некоторые эндотермические химические реакции. С повышением температуры все большее число реакций начинает самопроизвольно протекать в направлении эндотермического процесса; примерами таких реакций могут служить упомянутое выше разложение воды или протекающий при высоких температурах синтез оксида азота
Более того, принцип стремления к минимуму внутренней энергии требует, чтобы все экзотермические реакции доходили до конца, т. е. исключает возможность обратимых реакций; однако такие реакции реально существуют.
Вспомним теперь, что среди механических систем имеются такие, поведение которых тоже нельзя описать только направленностью процессов к достижению минимума потенциальной энергии. Это системы, состоящие из очень большого числа частиц. Например, молекулы, входящие в состав воздуха, распределяются вокруг Земли в виде атмосферы многокилометровой толщины, но не падают на Землю, хотя минимуму потенциальной энергии каждой молекулы соответствует наиболее низкое ее положение.
Из громадного числа частиц состоят и химические системы. Поэтому неудивительно, что и здесь тенденция к достижению минимума внутренней энергии не является единственным фактором, определяющим их поведение.
Для того чтобы составить представление о втором факторе, влияющем на направление реакций, рассмотрим какой-либо самопроизвольно протекающий процесс, не сопровождающийся тепловым эффектом. Примером такого процесса может служить расширение разреженного газа.
Пусть в части А сосуда, разделенного на две части (рис. 70), находится разреженный газ. В таком газе среднее расстояние между молекулами велико; при этом условии внутренняя энергия газа не зависит от степени его разрежения. Вторая половина сосуда (Б) газа не содержит. Если открыть кран, соединяющий обе части сосуда, то газ самопроизвольно распространится по всему сосуду.
Внутренняя энергия газа при этом не изменится; тем не менее, самопроизвольно произойдет именно процесс расширения газа, а обратный процесс - самопроизвольное сжатие газа - не происходит.
Причины такой направленности процесса можно понять, если сначала рассмотреть систему, содержащую небольшое число молекул. Пусть в сосуде находятся всего две молекулы, которые обозначим 1 и 2. Равномерное распределение газа между обеими частями сосуда, соответствующее определенному макросостоянию газа, может осуществиться двумя микросостояниями;
Макросостояние, при котором весь газ сосредоточен в одной из частей сосуда (например, в части А), осуществляется единственным микросостоянием:
Очевидно, что то или иное макросостояние системы тем более вероятно, чем большим числом микросостояний оно может осу-ществиться. В рассматриваемом случае (две молекулы) равномерное распределение газа по сосуду вдвое вероятнее, чем переход всего газа в часть сосуда А.
Пусть теперь в сосуде находится четыре молекулы, которые мы вновь пронумеруем. Переходу всего газа в часть сосуда А по-прежнему соответствует единственное микросостояние:
Между тем, равномерное распределение газа между обеими частями сосуда может теперь осуществляться шестью различными микросостояниями:

Теперь, следовательно, вероятность равномерного распределения молекул газа по всему объему сосуда оказывается заметно более высокой, чем вероятность их перехода в одну из его частей. Естественно, что равномерное распределение газа будет наблюдаться гораздо чаще, чем полное его сосредоточение в части сосуда.
Если в сосуде находится шесть молекул, то переходу их в одну из частей сосуда (т. е. самопроизвольному сжатию газа до половины занимаемого им первоначального объема), как и раньше, соответствует только одно микросостояние. Но равномерному распределению газа между обеими частями сосуда отвечает уже 20 возможных комбинаций молекул, т. е. 20 различных микросостояний:

Теперь явление самопроизвольного сжатия газа, т. е. сосредоточения всех его молекул в одной из частей сосуда, будет наблюдаться еще реже; равномерное же распределение газа по всему сосуду становится еще более вероятным.
Таким образом, с ростом числа молекул вероятность беспорядочного, равномерного распределения газа в сосуде очень быстро возрастает, а самопроизвольное сжатие газа становится все менее вероятным процессом. Если мы вспомним теперь, что макроскопические количества газа содержат огромное число молекул, то станет ясно, что в реальном опыте самопроизвольное сжатие газа представляет собой процесс практически невозможный, и что самопроизвольно будет протекать обратный процесс расширения газа, приводящий к равномерному, беспорядочному распределению его молекул по всему объему сосуда.
Рассмотренное нами явление расширения газа представляет собой пример проявления принципа направленности процессов к наиболее вероятному состоянию, т. е. к состоянию, которому соответствует максимальная беспорядочность распределения частиц. Направление самопроизвольного протекания химических реакций и определяется совокупным действием двух факторов: тенденцией к переходу системы в состояние с наименьшей внутренней энергией и тенденцией к достижению наиболее вероятного состояния.
Так, в приведенном примере с воздухом тенденция к минимуму потенциальной энергии заставляет молекулы, входящие в состав воздуха, падать на Землю, а тенденция к максимальной вероятности заставляет их беспорядочно распределяться в пространстве.
В результате создается некоторое равновесное распределение молекул, характеризующееся более высокой их концентрацией у поверхности Земли и все большим разрежением по мере удаления от Земли.
В системах соль-вода минимум внутренней энергии в большинстве случаев соответствует кристаллическому состоянию соли. Однако наиболее вероятное состояние системы достигается при беспорядочном распределении соли в жидкой воде. В результате совместного действия этих двух факторов устанавливается равновесие, соответствующее определенной концентрации насыщенного раствора соли.
При химических реакциях в силу принципа направленности процессов к минимуму внутренней энергии атомы соединяются в такие молекулы, при образовании которых выделяется наибольшее количество энергии. В силу же принципа направленности процессов к наиболее вероятному состоянию протекают такие реакции, в ходе которых возрастает число частиц (например, реакции разложения молекул на атомы) или чисто возможных состояний атомов.
Так, в случае реакции
минимальной внутренней энергии системы соответствует аммиак, образующийся при протекании реакции до конца вправо. Однако наиболее вероятному состоянию системы отвечает азото-водородная смесь, образующаяся при полном разложении аммиака, ибо при этом в 2 раза возрастает число молекул газов. Вследствие действия обоих фактором в системе устанавливается равновесие, отвечающее определенному при данной температуре соотношению концентраций всех веществ.
В случае реакции
минимальной внутренней энергии отвечает азото-кислородная смесь, образующаяся при полном разложении оксида азота. Поскольку в ходе этой реакции число частиц не изменяется, то протекание реакции до конца как в прямом, так и в обратном направлении не увеличивает вероятности состояния системы. Не изменяется при этом и число возможных состояний атомов: в исходных веществах каждый атом и азота, и кислорода связан с атомом того же элемента (молекулы и ), а в продукте реакции каждый атом связан с атомом другого элемента (молекула ). Иначе обстоит дело при частичном протекании процесса в прямом или в обратном направлении. В результате частичного прохождения реакции, т. е. при сосуществовании исходных веществ и продуктов реакции, атомы азота и кислорода находятся в двух состояниях: часть их связана в молекулы и , а часть - в молекулы .
Таким образом, число возможных микросостояний рассматриваемой системы, а следовательно, и вероятность соответствующего ее макросостояния возрастают при частичном протекании реакции. Итак, тенденция к уменьшению внутренней энергии способствует протеканию данной реакции до конца в обратном направлении, а тенденция к увеличению вероятности состояния вызывает ее частичное протекание в прямом направлении. Вследствие одновременного действия обоих факторов часть азотокислородной смеси при нагревании превращается в и устанавливается равновесие между исходными веществами и продуктом реакции.
Тенденция к переходу в состояние с наименьшей внутренней энергией проявляется при всех температурах в одинаковой степени. Тенденция же к достижению наиболее вероятного состояния проявляется тем сильнее, чем выше температура. Поэтому при низких температурах в большинстве случаев практически сказывается только влияние первой из этих тенденций, в результате чего самопроизвольно протекают экзотермические процессы. По мере возрастания температуры равновесие в химических системах все больше и больше сдвигается в сторону реакций разложения или увеличения числа состояний атомов. При этом каждой температуре отвечает состояние равновесия, характеризующееся определенным соотношением концентраций реагирующих веществ и продуктов реакции.
Оба рассмотренных фактора, а также результат их совместного действия можно выразить количественно. Величины, с помощью которых это делается, изучаются в разделе физики - термодинамике и называются термодинамическими величинами. К ним относятся, в частности, внутренняя энергия, энтальпия, энтропия и энергия Гиббса.