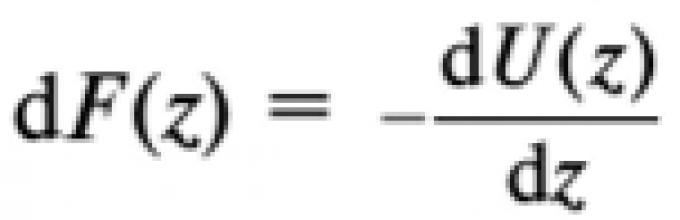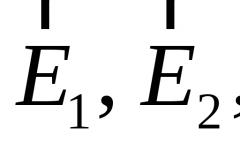Распределение молекул газа по потенциальной энергии (распределение Больцмана)
Идеальный газ во внешнем силовом поле
В идеальных газах молекулы рассматриваются невзаимодействующими друг с другом посредством межмолекулярных силовых полей, и их потенциальная энергия не фигурирует в газовых законах. Однако во внешних силовых полях эта ситуация меняется - молекулы приобретают потенциальную энергию из-за действия на них внешних сил. Эта потенциальная энергия учитывается в законах термодинамики.
При отсутствии внешних воздействий из-за хаотического теплового движения газ равномерно заполняет предоставленный ему объем. Однако при внешних воздействиях картина меняется, и потенциальная энергия влияет на распределение молекул газа в пространстве заключающего газ объема.
Найдем распределение молекул идеального газа в однородном, консервативном, одномерном внешнем силовом поле (например, поле силы тяжести вблизи поверхности Земли). Ориентируем выделенную ось Z вдоль направления силового воздействия (вертикально вверх, в нашем примере) и будем искать распределение концентрации (и давления) молекул вдоль этого направления.
Выделим в газе две параллельные плоскости (пластины) площадью S каждая, ориентированные перпендикулярно оси Z с дифференциально-малым расстоянием-промежутком d.z между ними (рис. 4.4). Из-за действия на молекулы силы F (вес в гравитационном поле) давление на нижнюю пластину будет больше, чем на верхнюю. Разница давлений dp равна действующим на пластины силам со стороны всех молекул в объеме dV= отнесенным к их площади S:
где F(z) - сила, действующая со стороны силового поля, на одну молекулу, находящуюся на уровне z n(z) - концентрация молекул на уровне Z-
Согласно заданным условиям сила является консервативной; это значит, что силовое поле - потенциальное. Поэтому можно воспользоваться связью между силой F(z) и потенциальной энергией U(z)
в форме
 (соотношение (1.33) в подразделе 1.3.5). Теперь можем записать
(соотношение (1.33) в подразделе 1.3.5). Теперь можем записать

Рис. 4.4.
Так как газ идеальный, его давление связано с концентрацией уравнением (4.25), а температура предполагается одинаковой в каждой точке, поэтому
Заменяя в (4.32) изменение давления на (4.33), получаем k^Tdn =
= -ndU.
Разделяя переменные, получим
 . Интегрирование
. Интегрирование
дает
 Это уравнение может быть переписано в виде
Это уравнение может быть переписано в виде
 И далее
И далее
 Предполагая, что на уровне, принятом за нуль отсчета (z
= 0) концентрация равна и 0 , получим С = п 0 .
Поэтому окончательно
Предполагая, что на уровне, принятом за нуль отсчета (z
= 0) концентрация равна и 0 , получим С = п 0 .
Поэтому окончательно
Полученное соотношение связывает между собой концентрацию молекул идеального газа n(z) и его давление p{z) с потенциальной энергией молекул U(z) в силовом поле с температурой Т. Это соотношение называется распределением Больцмана (или законом Больцмана). График закона Больцмана приведен для относительных концентраций n(z)/n 0 на рис. 4.5. Из него видно, что высокая концентрация молекул соответствует значениям координат z, где потенциальная энергия U(z) мала. С повышением потенциальной энергии концентрация молекул падает. При U(z ) = кьТ концентрация молекул в е раз меньше, чем на уровне, где U(z) = 0.

Рис. 4.5. Зависимость относительной концентрации частиц, находящихся в силовом поле, от величины потенциальной энергии U(z)
На рисунке 4.5 представлена совокупность кривых, соответствующих разным температурам газа. При возрастании температуры энергия хаотического движения молекул увеличивается и влияние температуры на концентрацию снижается. Поэтому при высокой температуре концентрация молекул выравнивается, газ равномерно заполняет весь объем. Наоборот, снижение температуры приводит к резкой зависимостью концентрации от потенциальной энергии. Влияние силового поля проявляется более резко.
Так как концентрация и давление пропорциональны друг другу для давления справедливо то, что говорилось ранее о концентрации. В частности, с учетом (4.25) формула (4.34) может быть переписана в виде:
в которой р 0 и p(z) есть давление в точках, где потенциальная энергия равна нулю и U(z), соответственно.
Барометрическая формула - зависимость давления или плотности газа от высоты в поле тяжести. Для идеального газа, имеющего постоянную температуру T и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), барометрическая формула имеет следующий вид:
где p - давление газа в слое, расположенном на высоте h, p0 - давление на нулевом уровне (h = h0), M - молярная масса газа, R - газовая постоянная, T - абсолютная температура. Из барометрической формулы следует, что концентрация молекул n (или плотность газа) убывает с высотой по тому же закону:  где M - молярная масса газа, R - газовая постоянная. Барометрическая формула показывает, что плотность газа уменьшается с высотой по экспоненциальному закону. Величина,
где M - молярная масса газа, R - газовая постоянная. Барометрическая формула показывает, что плотность газа уменьшается с высотой по экспоненциальному закону. Величина, ![]() определяющая быстроту спада плотности, представляет собой отношение потенциальной энергии частиц к их средней кинетической энергии, пропорциональной kT. Чем выше температура T, тем медленнее убывает плотность с высотой. С другой стороны, возрастание силы тяжести mg (при неизменной температуре) приводит к значительно большему уплотнению нижних слоев и увеличению перепада (градиента) плотности. Действующая на частицы сила тяжести mg может изменяться за счёт двух величин: ускорения g и массы частиц m. Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте. Пусть идеальный газ находится в поле консервативных сил в условиях теплового равновесия.
определяющая быстроту спада плотности, представляет собой отношение потенциальной энергии частиц к их средней кинетической энергии, пропорциональной kT. Чем выше температура T, тем медленнее убывает плотность с высотой. С другой стороны, возрастание силы тяжести mg (при неизменной температуре) приводит к значительно большему уплотнению нижних слоев и увеличению перепада (градиента) плотности. Действующая на частицы сила тяжести mg может изменяться за счёт двух величин: ускорения g и массы частиц m. Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте. Пусть идеальный газ находится в поле консервативных сил в условиях теплового равновесия.
Явления переноса в термодинамически неравновесных системах. Опытные
Полученная в § 92 барометрическая формула
(см. (92.4)) дает зависимость давления от высоты над поверхностью Земли для воображаемой изотермической атмосферы. Заменим в показателе экспоненты отношение равным ему отношением ( - масса молекулы, k - постоянная Больцмана). Кроме того, подставим в соответствии с (86.7) вместо выражение а вместо - выражение Сократив затем обе части равенства на придем к формуле
![]() (100.2)
(100.2)
Здесь - концентрация молекул (т. е. число их в единице объема) на высоте - концентрация молекул на высоте
Из формулы (100.2) следует, что с понижением температуры число частиц на высотах, отличных от нуля, убывает, обращаясь в нуль при (рис. 100.1). При абсолютном нуле все молекулы расположились бы на земной поверхности.
При высоких температурах, напротив, слабо убывает с высотой, так что молекулы оказываются распределенными по высоте почти равномерно.
Этот факт имеет простое физическое объяснение. Каждое конкретное распределение молекул по высоте устанавливается в результате действия двух тенденций: 1) притяжение молекул к Земле (характеризуемое силой ) стремится расположить их на поверхности Земли; 2) тепловое движение (характеризуемое величиной ) стремится разбросать молекулы равномерно по всем высотам. Чем больше и меньше Т, тем сильнее преобладает первая тенденция, и молекулы сгущаются у поверхности Земли. В пределе при тепловое движение совсем прекращается, и под влиянием притяжения молекулы располагаются на земной поверхности. При высоких температурах превалирует тепловое движение, и плотность молекул медленно убывает с высотой.
На разной высоте молекула обладает различным запасом по тенциальной энергии:
Следовательно, распределение молекул по высоте является вместе с тем и распределением их по значениям потенциальной энергии. С учетом (100.3) формулу (100.2) можно записать следующим образом:
![]()
где - плотность молекул в том месте пространства, где потенциальная энергия молекулы имеет значение - плотность молекул в том месте, где потенциальная энергия молекулы равна нулю.
Из (100.4) следует, что молекулы располагаются с большей плотностью там, где меньше их потенциальная энергия, и, наоборот, с меньшей плотностью - в местах, где их потенциальная энергия больше.
В соответствии с (100.4) отношение в точках, где потенциальная энергия молекулы имеет значения равно
![]()

Больцман доказал, что распределение (100.4) справедливо не только в случае потенциального поля сил земного тяготения, но и в любом потенциальном поле сил для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения. В соответствии с этим распределение (100.4) называют распределением Больцмана.
В то время как закон Максвелла дает распределение частиц по значениям кинетической энергии, закон Больцмана дает распределение частиц по значениям потенциальной энергии. Для обоих распределений характерно наличие экспоненциального множителя, в показателе которого стоит отношение кинетической или соответственно потенциальной энергии одной молекулы к величине, определяющей среднюю энергию теплового движения молекулы.
Согласно формуле (100.4) количество молекул, попадающих в пределы объема расположенного в точке с координатами х, у, z, равно
Мы получили еще одно выражение закона распределения Больцмана.
Распределения Максвелла и Больцмана можно объединить в один закон Максвелла - Больцмана, согласно которому число молекул, компоненты скорости которых лежат в пределах от до а координаты в пределах от х, у, z до равно
Заменив в Барометрической формуле p через nkT получим закон изменения концентрации газа с высотой:
Где n 0 – концентрация газа на высоте h=0
Преобразуем, заменив M/R равным ему отношению m 0 /k
Где m 0 - масса одной молекулы, k – постоянная Больцмана
![]()
С уменьшением температуры концентрации газа на высотах отличных от нуля, убывает, обращаясь в ноль при температуре T=0
При абсолютном нуле все молекулы воздуха расположились бы на земной поверхности.
При больших температурах наоборот концентрация слабо уменьшается с высотой.
Распределение молекул газа получается в результате действия двух «конкурирующих» тенденций: 1. притяжение к земле, 2. тепловое движение
На разной высоте молекула обладает разной потенциальной энергией => распределение молекул газа по высоте, является в тоже время распределением их по значениям потенциальной энергии.
Таким образом получаем:
Из этого => что молекулы располагаются с большей концентрацией (плотностью) тела, где их потенциальная энергия меньше, и наоборот, с меньшей плотностью в местах, где их потенциальная энергия больше.
Среднее число столкновений и средняя длина свободного пробега молекул .
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь l, который называется длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с огромным числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d (рис. 68). Он зависит от скорости сталкивающихся молекул, т. е. от температуры газа (несколько уменьшается с ростом температуры).
Так как за 1 с молекула проходит в среднем путь, равный средней арифметической скорости

Для определения
Среднее число столкновений за 1 с равно числу молекул в объеме «ломаного» цилиндра:
где n - концентрация молекул, V = pd2
![]()
Расчеты показывают, что при учете движения других молекул
При рассмотрении кинетической теории газов и закона распределения Максвелла предполагалось, что на молекулы газа не действуют никакие силы, за исключением ударов молекул. Поэтому, молекулы равномерно распределяются по всему сосуду. В действительности молекулы любого газа всегда находятся в поле тяготения Земли. Вследствие этого, каждая молекула массой m испытывает действие силы тяжести f =mg.
Выделим горизонтальный элемент объема газа высотой dh и площадью основания S (рис. 11.2). Считаем газ однородным и температуру его постоянной. Число молекул в этом объеме равно произведению его объема dV=Sdh на число молекул в единице объема. Полный вес молекул в выделенном элементе равен
Действие веса dF вызывает давление, равное
| | (11.2) |
минус - т.к. при увеличении dh давление уменьшается. Согласно основному уравнению молекулярно-кинетической теории Приравнивая правые части (11.2) и (11.3), получаем
Или
Интегрируя это выражение в пределах от до h (соответственно концентрация изменяется от до n):
Получим
Потенцируя полученное выражение, находим
Показатель степени при exp имеет множитель , который определяет приращение потенциальной энергии молекул газа. Если переместить молекулу с уровня до уровня h, то изменение ее потенциальной энергии будет Тогда уравнение для концентрации молекул преобразуется к виду
Это уравнение отображает общий закон Больцмана и дает распределение числа частиц в зависимости от их потенциальной энергии. Он применим к любой системе частиц, находящихся в силовом поле, например в электрическом.
28. Броуновское движение. Столкновение молекул в газе. Длина свободного пробега.
Броуновское движение– это непрерывное хаотическое движение малых частиц, взвешенных в жидкости или газе (при этом подразумевается, что сила тяжести не влияет на их движение). В газе броуновское движение совершают, например, взвешенные в воздухе частицы пыли или дыма. Броуновское движение частицы возникает потому, что импульсы, с которыми молекулы жидкости или газа действуют на эту частицу, не компенсируют друг друга. Молекулы среды (то есть молекулы газа или жидкости) движутся хаотично, поэтому их удары приводят броуновскую частицу в беспорядочное движение: броуновская частица быстро меняет свою скорость по направлению и по величине. Броуновское движение – это тепловое движение, интенсивность которого возрастает с ростом температуры среды и продолжается неограниченно долго без каких-либо видимых изменений. Интенсивность броуновского движения также возрастает с уменьшением размера и массы частиц, а также при уменьшении вязкости среды. Броуновское движение служит наиболее наглядным экспериментальным подтверждением существования атомов (молекул) и их хаотического теплового движения. Длина свободного пробега молекулы - это среднее расстояние, которое частица пролетает за время свободного пробега от одного столкновения до следующего. Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега. Величина является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.