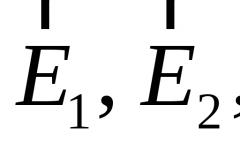Кислотно-основные свойства аминокислот связаны с наличием в их структуре двух ионизируемых групп-карбоксильной и аминогруппы, поэтому амнокислоты могут проявлять свойства как кислот, так и оснований, т.е. они являются амфотерными соединениями. В кристаллическом состоянии и в водных растворах -аминокислоты существуют в виде биполярных ионов, называемых также цвиттерионами. Ионное строение обуславливает некоторые особенности свойств-аминокислот: высокую температуру плавления (200-300С), нелетучесть, растворимость в воде и нерастворимость в неполярных органических растворителях. С растворимостью аминокислот в воде связана их всасываемость и транспорт в организме. Ионизация молекул аминокислот зависит от рН раствора. Для моноаминомонокарбоновых кислот процесс диссоциации имеет следующий вид:
В сильно кислых растворах аминокислоты присутствуют в виде положительных ионов, а в щелочных – в виде отрицательных.
Кислотно-основные свойства аминокислот можно объяснить исходя из теории кислот и оснований Бренстеда-Лоури. Полностью протонированная -аминокислота (катионная форма) с позиции теории Бренстеда является двухосновной кислотой, содержащей две кислотные группы:недиссоциированную карбоксильную группу (– СООН) и протонированную аминогруппу (NН 3), которые характеризуются соответствующими значениями рК 1 и рК 2 .
Величины рК для аминокислот определяют по кривым титрования. Рассмотрим кривую титрования аланина (рис. 1).

Рис. 1 – кривые, полученные при титровании 0,1М раствора аланина 0,1М раствором HCl(а) и 0,1М расторомNaOH(б).
Из кривой титрования аланина следует, что карбоксильная группа имеет рК 1 =2,34, а протонированная аминогруппа рК 2 = 9,69. При рН = 6,02 аланин существует в виде биполярного иона, когда суммарный электрический заряд частицы равен 0. При этом значении рН молекула аланина электронейтральна. Такое значение рН называют изоэлектрической точкой и обозначают рН иэт или рI. Для моноаминомонокарбоновых кислот изоэлектрическая точка рассчитывается как среднее арифметическое двух значений рК . Например для аланина она равна:
рI= ½(рК 1 + рК 2) = ½(2,34 + 9,69) = 6,02
При значении рН, превышающем изоэлектрическую точку, аминокислота заряжается отрицательно, а при значении рН ниже рIаминокислота несет суммарный положительный заряд. Например, при рН = 1,0 все молекулы аланина существуют в форме ионов

с суммарным зарядом +1. При рН = 2,34, когда имеется смесь равных количеств ионов

суммарный заряд = +0,5. Аналогичным образом можно предсказать знак и величину суммарного заряда для любой другой аминокислоты при любом значении рН.
Аминокислоты с ионизируемой группой в радикале имеют более сложные кривые титрования, складывающиеся из 3-ох участков, соответствующих трем возможным стадиям ионизации, и, следовательно, они имеют три значения рК (рК 1 , рК 2 и рК R). Ионизация кислых аминокислот, например аспарагиновой, состоит из следующих последовательных стадий:

Изоэлектрические точки таких аминокислот определяются также присутствием ионизируемой группой радикала, наряду с -амино и-карбоксильными группами. Для моноаминодикарбоновых кислот изоэлектрические точки смещены в кислую область рН и определяются как среднее арифметическое между величинами рК для двух карбоксильных групп (рIаспарагиновой кислоты = 2,97). Для основных аминокислот рIсмещены в щелочную область и вычисляются как среднее арифметическое между величинами рК для двух протонированных аминогрупп (рIлизина = 9,74).
Кислотно-основные свойства аминокислот используются для разделения и последующей идентификации аминокислот методами электрофореза и ионообменной хроматографии. Оба эти метода основаны на различиях в знаке и величине суммарного электрического заряда при данном значении рН.
Все -аминокислоты, кроме глицина, содержат хиральный -углеродный атом и могут встречаться в виде энантиомеров :
Было доказано, что почти все природные -аминокислоты обладают одной и той же относительной конфигурацией при -углеродном атоме. -Углеродному атому (-)-серина была условно приписана L -конфигурация, а -углеродному атому (+)-серина - D -конфигурация. При этом, если проекция -аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R - внизу, у L -аминокислоты аминогруппа будет находиться слева, а у D -аминокислоты - справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем -аминокислотам, обладающим хиральным -углеродным атомом.
Из рисунка видно, что L -аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство -аминокислот, встречающихся в природе, относится к L -ряду. Их энантиоморфы , т.е. D -аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами .
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при -углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты - амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН ), так и основной (-NH 2 ) группы в одной и той же молекуле. В очень кислых растворах NH 2 -группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (биполярных ионов, внутренних солей ). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах - к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты.
РЕАКЦИИ АМИНОКИСЛОТ
Большинство реакций, в которые аминокислоты вступают в лабораторных условиях (in vitro ), свойственны всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат), трет -бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитную группу затем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.

2. образование амидов по аминогруппе. При ацилировании аминогруппы -аминокислоты образуется амид.

Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:

Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из -аминокислот, называются пептидами или полипептидами . Амидная связь в таких полимерах называется пептидной связью . Полипептиды с молекулярной массой не меньше 5000 называют белками . В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка . Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков . Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка . Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин ), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структура определяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы - фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные (отношение меньше 10). К фибриллярным белкам относится коллаген , наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов .
Аминокислоты — это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н 2 N -СН 2 -СООН + HCl → Сl [Н 3 N-СН 2 -СООН],
Н 2 N -СН 2 -СООН + NaOH → H 2 N-CH 2 -COONa + Н 2 О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H 2 N-CH 2 -СООН + Н 3 N -СН 2 -СОO — .
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:

Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH 2), лизин — щелочной (одна группа -СООН, две -NH 2).
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота - в гидроксикислоту:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка ).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H 2 N-CH(R)-COOH + R’OH H 2 N-CH(R)-COOR’ + Н 2 О.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Важнейшее свойство аминокислот - их способность к конденсации с образованием пептидов.
Качественные реакции .
1) Все аминокислоты окисляются нингидрином

с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос - желтый).
Аминокислоты представляют собой структурные химические единицы или "строительные кирпичики", образующие белки. Аминокислоты на 16% состоят из азота, это является их основным химическим отличием от двух других важнейших элементов питания - углеводов и жиров. Важность аминокислот для организма определяется той огромной ролью, которую играют белки во всех процессах жизнедеятельности.
Любой живой организм от самых крупных животных до крошечных микробов состоит из белков. Разнообразные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти. Белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит этих элементов питания в организме может привести к нарушению водного баланса, что вызывает отеки.
Каждый белок в организме уникален и существует для специальных целей. Белки не являются взаимозаменяемыми. Они синтезируются в организме из аминокислот, которые образуются в результате расщепления белков, находящихся в пищевых продуктах. Таким образом, именно аминокислоты, а не сами белки являются наиболее ценными элементами питания. Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма, некоторые из них выполняют роль нейромедиаторов (нейротрансмиттеров) или являются их предшественниками.
Нейромедиаторы - это химические вещества, передающие нервный импульс от одной нервной клетки другой. Таким образом, некоторые аминокислоты необходимы для нормальной работы головного мозга. Аминокислоты способствуют тому, что витамины и минералы адекватно выполняют свои функции. Некоторые аминокислоты непосредственно снабжают энергией мышечную ткань.
В организме человека многие аминокислоты синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей. К таким незаменимым аминокислотам относятся - гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Аминокислоты, которые синтезируются в печен: аланин, аргинин, аспарагин, аспарагиновая кислота, цитруллин, цистеин, гамма-аминомасляную кислоту, глютамин и глютаминовая кислота, глицин, орнитин, пролин, серин, таурин, тирозин.
Процесс синтеза белков идет в организме постоянно. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным проблемам - от нарушения пищеварения до депрессии и замедления роста.
Как возникает такая ситуация? Легче, чем это можно себе представить. Многие факторы приводят к этому, даже, если ваше питание сбалансировано и вы потребляете достаточное количество белка. Нарушение всасывания в желудочно-кишечном тракте, инфекция, травма, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме - все это может привести к дефициту незаменимых аминокислот.
Следует иметь в виду, что все вышесказанное вовсе не означает, что потребление большого количества белков поможет решить любые проблемы. В действительности, это не способствует сохранению здоровья.
Избыток белков создает дополнительный стресс для почек и печени, которым надо перерабатывать продукты метаболизма белков, основным из них является аммиак. Он очень токсичен для организма, поэтому печень немедленно перерабатывает его в мочевину, которая затем поступает с током крови в почки, где отфильтровывается и выводится наружу.
До тех пор, пока количество белка не слишком велико, а печень работает хорошо, аммиак нейтрализуется сразу же и не причиняет никакого вреда. Но если его слишком много и печень не справляется с его обезвреживанием (в результате неправильного питания, нарушения пищеварения и/или заболеваний печени) - в крови создается токсический уровень аммиака. При этом может возникнуть масса серьезных проблем со здоровьем, вплоть до печеночной энцефалопатии и комы.
Слишком высокая концентрация мочевины также вызывает повреждение почек и боли в спине. Следовательно, важным является не количество, а качество потребляемых с пищей белков. В настоящее время можно получать незаменимые и заменимые аминокислоты в виде биологически активных пищевых добавок.
Это особенно важно при различных заболеваниях и при применении редукционных диет. Вегетарианцам необходимы такие добавки, содержащие незаменимые аминокислоты, чтобы организм получал все необходимое для нормального синтеза белков.
 Имеются разные виды добавок, содержащих аминокислоты. Аминокислоты входят в состав некоторых поливитаминов, белковых смесей. Есть в продаже формулы, содержащие комплексы аминокислот или содержащие одну или две аминокислоты . Они представлены в различных формах: в капсулах, таблетках, жидкостях и порошках.
Имеются разные виды добавок, содержащих аминокислоты. Аминокислоты входят в состав некоторых поливитаминов, белковых смесей. Есть в продаже формулы, содержащие комплексы аминокислот или содержащие одну или две аминокислоты . Они представлены в различных формах: в капсулах, таблетках, жидкостях и порошках.
Большинство аминокислот существует в виде двух форм, химическая структура одной является зеркальным отображением другой. Они называются D- и L-формами, например D-цистин и L-цистин.
D означает dextra (правая на латыни), а L - levo (соответственно, левая). Эти термины обозначают направление вращения спирали, являющейся химической структурой данной молекулы. Белки животных и растительных организмов созданы в основном L-формами аминокислот (за исключением фенилаланина, который представлен D, L формами).
Пищевые добавки, содержащие L-аминокислоты, считаются более подходящими для биохимических процессов человеческого организма.
Свободные, или несвязанные, аминокислоты представляют собой наиболее чистую форму. Поэтому при выборе добавки, содержащей аминокислоты, предпочтение следует отдавать продуктам, содержащим L-кристаллические аминокислоты, стандартизированные по Американской Фармакопее (USP). Они не нуждаются в переваривании и абсорбируются непосредственно в кровоток. После приема внутрь всасываются очень быстро и, как правило, не вызывают аллергических реакций.
Отдельные аминокислоты принимают натощак, лучше всего утром или между приемами пищи с небольшим количеством витаминов В6 и С. Если вы принимаете комплекс аминокислот, включающий все незаменимые, это лучше делать через 30 минут после или за 30 минут до еды. Лучше всего принимать и отдельные нужные аминокислоты, и комплекс аминокислот, но в разное время. Отдельно аминокислоты не следует принимать в течение длительного времени, особенно в высоких дозах. Рекомендуют прием в течение 2 месяцев с 2-месячным перерывом.
Аланин
Аланин способствует нормализации метаболизма глюкозы. Установлена взаимосвязь между избытком аланина и инфицированием вирусом Эпштейна-Барра, а также синдромом хронической усталости. Одна из форм аланина - бета-аланин является составной частью пантотеновой кислоты и коэнзима А - одного из самых важных катализаторов в организме.
Аргинин
Аргинин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Он повышает активность и увеличивает размер вилочковой железы, которая вырабатывает Т-лимфоциты. В связи с этим аргинин полезен людям, страдающим ВИЧ-инфекцией и злокачественными новообразованиями.
Его также применяют при заболеваниях печени (циррозе и жировой дистрофии), он способствует дезинтоксикационным процессам в печени (прежде всего обезвреживанию аммиака). Семенная жидкость содержит аргинин, поэтому его иногда применяют в комплексной терапии бесплодия у мужчин. В соединительной ткани и в коже также находится большое количество аргинина, поэтому его прием эффективен при различных травмах. Аргинин - важный компонент обмена веществ в мышечной ткани. Он способствует поддержанию оптимального азотного баланса в организме, так как участвует в транспортировке и обезвреживании избыточного азота в организме.
Аргинин помогает снизить вес, так как вызывает некоторое уменьшение запасов жира в организме.
 Аргинин входит в состав многих энзимов и гормонов. Он оказывает стимулирующее действие на выработку инсулина поджелудочной железой в качестве компонента вазопрессина (гормона гипофиза) и помогает синтезу гормона роста. Хотя аргинин синтезируется в организме, его образование может быть снижено у новорожденных. Источниками аргинина являются шоколад, кокосовые орехи, молочные продукты, желатин, мясо, овес, арахис, соевые бобы, грецкие орехи, белая мука, пшеница и пшеничные зародыши.
Аргинин входит в состав многих энзимов и гормонов. Он оказывает стимулирующее действие на выработку инсулина поджелудочной железой в качестве компонента вазопрессина (гормона гипофиза) и помогает синтезу гормона роста. Хотя аргинин синтезируется в организме, его образование может быть снижено у новорожденных. Источниками аргинина являются шоколад, кокосовые орехи, молочные продукты, желатин, мясо, овес, арахис, соевые бобы, грецкие орехи, белая мука, пшеница и пшеничные зародыши.
Люди, имеющие вирусные инфекции, в том числе Herpes simplex, не должны принимать аргинин в виде пищевых добавок и должны избегать потребления продуктов, богатых аргинином. Беременным и кормящим грудью матерям не следует употреблять пищевые добавки с аргинином. Прием небольших доз аргинина рекомендуется при заболеваниях суставов и соединительной ткани, при нарушениях толерантности к глюкозе, заболеваниях печени и травмах. Длительный прием не рекомендован.
Аспарагин
Аспарагин необходим для поддержания баланса в процессах, происходящих в центральной нервной системе: препятствует как чрезмерному возбуждению, так и излишнему торможению. Он участвует в процессах синтеза аминокислот в печени.
Так как эта аминокислота повышает жизненную силу, добавку на ее основе применяют при усталости. Она играет также важную роль в процессах метаболизма. Аспартовую кислоту часто назначают при заболеваниях нервной системы. Она полезна спортсменам, а также при нарушениях функции печени. Кроме того, он стимулирует иммунитет за счет повышения продукции иммуноглобулинов и антител.
Аспартовая кислота в больших количествах содержится в белках растительного происхождения, полученных из пророщенных семян и в мясных продуктах.
Карнитин
Строго говоря, карнитин не является аминокислотой, но его химическая структура сходна со структурой аминокислот, и поэтому их обычно рассматривают вместе. Карнитин не участвует в синтезе белков и не является нейромедиатором. Его основная функция в организме - это транспорт длинноцепочечных жирных кислот, в процессе окисления которых выделяется энергия. Это один из основных источников энергии для мышечной ткани. Таким образом, карнитин увеличивает переработку жира в энергию и предотвращает отложение жира в организме, прежде всего в сердце, печени, скелетной мускулатуре.
Карнитин снижает вероятность развития осложнений сахарного диабета, связанных с нарушениями жирового обмена, замедляет жировое перерождение печени при хроническом алкоголизме и риск возникновения заболеваний сердца. Он обладает способностью снижать уровень триглицеридов в крови, способствует снижению массы тела и повышает силу мышц у больных с нервно-мышечными заболеваниями и усиливает антиоксидантное действие витаминов С и Е.
Считается, что некоторые варианты мышечных дистрофий связаны с дефицитом карнитина. При таких заболеваниях люди должны получать большее количество этого вещества, чем это положено по нормам.
Он может синтезироваться в организме при наличии железа, тиамина, пиридоксина и аминокислот лизина и метионина. Синтез карнитина осуществляется в присутствии также достаточного количества витамина С. Недостаточное количество любого из этих питательных веществ в организме приводит к дефициту карнитина. Карнитин поступает в организм с пищей, прежде всего с мясом и другими продуктами животного происхождения.
 Большинство случаев дефицита карнитина связано с генетически обусловленным дефектом в процессе его синтеза. К возможным проявлениям недостаточности карнитина относятся нарушения сознания, боли в сердце, слабость в мышцах, ожирение.
Большинство случаев дефицита карнитина связано с генетически обусловленным дефектом в процессе его синтеза. К возможным проявлениям недостаточности карнитина относятся нарушения сознания, боли в сердце, слабость в мышцах, ожирение.
Мужчинам вследствие большей мышечной массы требуется большее количество карнитина, чем женщинам. У вегетарианцев более вероятно возникновение дефицита этого питательного вещества, чем у невегетарианцев, в связи с тем, что карнитин не встречается в белках растительного происхождения.
Более того, метионин и лизин (аминокислоты, необходимые для синтеза карнитина) также не содержатся в растительных продуктах в достаточных количествах.
Для получения необходимого количества карнитина вегетарианцы должны принимать пищевые добавки или есть обогащенные лизином продукты, такие как кукурузные хлопья.
Карнитин представлен в биологически активных пищевых добавках в различных формах: в виде D, L-карнитина, D-карнитина, L-карнитина, ацетил-L-карнитина.
Предпочтительнее принимать L-карнитин.
Цитруллин
Цитруллин преимущественно находится в печени. Он повышает энергообеспечение, стимулирует иммунную систему, в процессе обмена веществ превращается в L-аргинин. Он обезвреживает аммиак, повреждающий клетки печени
Цистеин и цистин
Эти две аминокислоты тесно связаны между собой, каждая молекула цистина состоит из двух молекул цистеина, соединенных друг с другом. Цистеин очень нестабилен и легко переходит в L-цистин, и, таким образом, одна аминокислота легко переходит в другую при необходимости.
Обе аминокислоты относятся к серосодержащим и играют важную роль в процессах формирования тканей кожи, имеют значение для дезинтоксикационных процессов. Цистеин входит в состав альфа-кератина - основного белка ногтей, кожи и волос. Он способствует формированию коллагена и улучшает эластичность и текстуру кожи. Цистеин входит в состав и других белков организма, в том числе некоторых пищеварительных ферментов.
Цистеин помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации. Он представляет собой один из самых мощных антиоксидантов, при этом его антиоксидантное действие усиливается при одновременном приеме с витамином С и селеном.
Цистеин является предшественником глютатиона - вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторых лекарственных препаратов и токсических веществ, содержащихся в сигаретном дыме. Цистеин растворяется лучше, чем цистин, и быстрее утилизируется в организме, поэтому его чаще используют в комплексном лечении различных заболеваний. Это аминокислота образуется в организме из L-метионина, при обязательном присутствии витамина В6.
Дополнительный прием цистеина необходим при ревматоидном артрите, заболеваниях артерий, раке. Он ускоряет выздоровление после операций, ожогов, связывает тяжелые металлы и растворимое железо. Эта аминокислота также ускоряет сжигание жиров и образование мышечной ткани.
L-цистеин обладает способностью разрушать слизь в дыхательных путях, благодаря этому его часто применяют при бронхитах и эмфиземе легких. Он ускоряет процессы выздоровления при заболеваниях органов дыхания и играет важную роль в активизации лейкоцитов и лимфоцитов.
Так как это вещество увеличивает количество глютатиона в легких, почках, печени и красном костном мозге, оно замедляет процессы старения, например, уменьшая количество старческих пигментных пятен. N-ацетилцистеин более эффективно повышает уровень глютатиона в организме, чем цистин или даже сам глютатион.
Люди с сахарным диабетом должны быть осторожны при приеме добавок с цистеином, так как он обладает способностью инактивировать инсулин. При цистинурии, редком генетическом состоянии, приводящем к образованию цистиновых камней, принимать цистеин нельзя.
Диметилглицин
Диметилглицин - это производная глицина - самой простой аминокислоты. Он является составным элементом многих важных веществ, таких как аминокислоты метионин и холин, некоторых гормонов, нейромедиаторов и ДНК.
 В небольших количествах диметилглицин встречается в мясных продуктах, семенах и зернах. Хотя с дефицитом диметилглицина не связано никаких симптомов, прием пищевых добавок с диметилглицином оказывает целый ряд положительных эффектов, включая улучшение энергообеспечения и умственной деятельности.
В небольших количествах диметилглицин встречается в мясных продуктах, семенах и зернах. Хотя с дефицитом диметилглицина не связано никаких симптомов, прием пищевых добавок с диметилглицином оказывает целый ряд положительных эффектов, включая улучшение энергообеспечения и умственной деятельности.
Диметилглицин также стимулирует иммунитет, уменьшает содержание холестерина и триглицеридов в крови, помогает нормализации артериального давления и уровня глюкозы, а также способствует нормализации функции многих органов. Его также применяют при эпилептических припадках.
Гамма-аминомасляная кислота
Гамма-аминомасляная кислота (GABA) выполняет в организме функцию нейромедиатора центральной нервной системы и незаменима для обмена веществ в головном мозге. Образуется она из другой аминокислоты - глютаминовой. Она уменьшает активность нейронов и предотвращает перевозбуждение нервных клеток.
Гамма-аминомасляная кислота снимает возбуждение и оказывает успокаивающее действие, ее можно принимать также как транквилизаторы, но без риска развития привыкания. Эту аминокислоту используют в комплексном лечении эпилепсии и артериальной гипертензии. Так как она оказывает релаксирующее действие, ее применяют при лечении нарушений половых функций. Кроме того, GABA назначают при синдроме дефицита внимания. Избыток гамма-аминомасляной кислоты, однако, может увеличить беспокойство, вызывает одышку, дрожание конечностей.
Глютаминовая кислота
Глютаминовая кислота является нейромедиатором, передающим импульсы в центральной нервной системе. Эта аминокислота играет важную роль в углеводном обмене и способствует проникновению кальция через гематоэнцефалический барьер.
Эта аминокислота может использоваться клетками головного мозга в качестве источника энергии. Она также обезвреживает аммиак, отнимая атомы азота в процессе образования другой аминокислоты - глютамина. Этот процесс - единственный способ обезвреживания аммиака в головном мозге.
Глютаминовую кислоту применяют при коррекции расстройств поведения у детей, а также при лечении эпилепсии, мышечной дистрофии, язв, гипогликемических состояний, осложнений инсулинотерапии сахарного диабета и нарушений умственного развития.
Глютамин
Глютамин - это аминокислота, наиболее часто встречающаяся в мышцах в свободном виде. Он очень легко проникает через гематоэнцефалический барьер и в клетках головного мозга переходит в глютаминовую кислоту и обратно, кроме того увеличивает количество гамма-аминомасляной кислоты, которая необходима для поддержания нормальной работы головного мозга.
Эта аминокислота также поддерживает нормальное кислотно-щелочное равновесие в организме и здоровое состояние желудочно-кишечного тракта, необходим для синтеза ДНК и РНК.
Глютамин - активный участник азотного обмена. Его молекула содержит два атома азота и образуется из глютаминовой кислоты путем присоединения одного атома азота. Таким образом, синтез глютамина помогает удалить избыток аммиака из тканей, прежде всего из головного мозга и переносить азот внутри организма.
Глютамин находится в больших количествах в мышцах и используется для синтеза белков клеток скелетной мускулатуры. Поэтому пищевые добавки с глютамином применяются культуристами и при различных диетах, а также для профилактики потери мышечной массы при таких заболеваниях, как злокачественные новообразования и СПИД, после операций и при длительном постельном режиме.
Дополнительно глютамин применяют также при лечении артритов, аутоиммунных заболеваниях, фиброзах, заболеваниях желудочно-кишечного тракта, пептических язвах, заболеваниях соединительной ткани.
 Эта аминокислота улучшает деятельность мозга и поэтому применяется при эпилепсии, синдроме хронической усталости, импотенции, шизофрении и сенильной деменции. L-глютамин уменьшает патологическую тягу к алкоголю, поэтому применяется при лечении хронического алкоголизма.
Эта аминокислота улучшает деятельность мозга и поэтому применяется при эпилепсии, синдроме хронической усталости, импотенции, шизофрении и сенильной деменции. L-глютамин уменьшает патологическую тягу к алкоголю, поэтому применяется при лечении хронического алкоголизма.
Глютамин содержится во многих продуктах как растительного, так и животного происхождения, но он легко уничтожается при нагревании. Шпинат и петрушка являются хорошими источниками глютамина, но при условии, что их потребляют в сыром виде.
Пищевые добавки, содержащие глютамин, следует хранить только в сухом месте, иначе глютамин переходит в аммиак и пироглютаминовую кислоту. Не принимают глютамин при циррозе печени, заболеваниях почек, синдроме Рейе.
Глютатион
Глютатион, так же как и карнитин, не является аминокислотой. По химической структуре это трипептид, получаемый в организме из цистеина, глютаминовой кислоты и глицина.
Глютатион является антиоксидантом. Больше всего глютатиона находится в печени (некоторое его количество высвобождается прямо в кровоток), а также в легких и желудочно-кишечном тракте.
Он необходим для углеводного обмена, а также замедляет старение за счет влияния на липидный обмен и предотвращает возникновения атеросклероза. Дефицит глютатиона сказывается прежде всего на нервной системе, вызывая нарушения координации, мыслительных процессов, тремор.
Количество глютатиона в организме уменьшается с возрастом. В связи с этим пожилые люди должны получать его дополнительно. Однако предпочтительнее употреблять пищевые добавки, содержащие цистеин, глютаминовую кислоту и глицин - то есть вещества, синтезирующие глютатион. Наиболее эффективным считается прием N-ацетилцистеина.
Глицин
Глицин замедляет дегенерацию мышечной ткани, так как является источником креатина - вещества, содержащегося в мышечной ткани и используемого при синтезе ДНК и РНК. Глицин необходим для синтеза нуклеиновых кислот, желчных кислот и заменимых аминокислот в организме.
Он входит в состав многих антацидных препаратов, применяемых при заболеваниях желудка, полезен для восстановления поврежденных тканей, так как в больших количествах содержится в коже и соединительной ткани.
Эта аминокислота необходима для нормального функицонирования центральной нервной системы и поддержки хорошего состояния предстательной железы. Он выполняет функцию тормозного нейромедиатора и, таким образом, может предотвратить эпилептические судороги.
Глицин применяют в лечении маниакально-депрессивного психоза, он также может быть эффективен при гиперактивности. Избыток глицина в организме вызывает чувство усталости, но адекватное количество обеспечивает организм энергией. При необходимости глицин в организме может превращаться в серин.
Гистидин
Гистидин - это незаменимая аминокислота, способствующая росту и восстановлению тканей, которая входит в состав миелиновых оболочек, защищающих нервные клетки, а также необходима для образования красных и белых клеток крови. Гистидин защищает организм от повреждающего действия радиации, способствует выведению тяжелых металлов из организма и помогает при СПИДе.
Слишком высокое содержание гистидина может привести к возникновению стресса и даже психических нарушений (возбуждения и психозов).
Неадекватное содержание гистидина в организме ухудшает состояние при ревматоидном артрите и при глухоте, связанной с поражением слухового нерва. Метионин способствует понижению уровня гистидина в организме.
 Гистамин, очень важный компонент многих иммунологических реакций, синтезируется из гистидина. Он также способствует возникновению полового возбуждения. В связи с этим одновременный прием биологически активных пищевых добавок, содержащих гистидин, ниацин и пиридоксин (необходимых для синтеза гистамина), может оказаться эффективным при половых расстройствах.
Гистамин, очень важный компонент многих иммунологических реакций, синтезируется из гистидина. Он также способствует возникновению полового возбуждения. В связи с этим одновременный прием биологически активных пищевых добавок, содержащих гистидин, ниацин и пиридоксин (необходимых для синтеза гистамина), может оказаться эффективным при половых расстройствах.
Так как гистамин стимулирует секрецию желудочного сока, применение гистидина помогает при нарушениях пищеварения, связанных с пониженной кислотностью желудочного сока.
Люди, страдающие маниакально-депрессивным психозом, не должны принимать гистидин, за исключением случаев, когда дефицит этой аминокислоты точно установлен. Гистидин находится в рисе, пшенице и ржи.
Изолейцин
Изолейцин - одна из аминокислот BCAA и незаменимых аминокислот, необходимых для синтеза гемоглобина. Также стабилизирует и регулирует уровень сахара в крови и процессы энергообеспечения.Метаболизм изолейцина происходит в мышечной ткани.
Совместный прием с изолейцином и валином (BCAA) увеличиваtт выносливость и способствуют восстановлению мышечной ткани, что особенно важно для спортсменов.
 Изолейцин необходим при многих психических заболеваниях. Дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
Изолейцин необходим при многих психических заболеваниях. Дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
К пищевым источниками изолейцина относятся миндаль, кешью, куриное мясо, турецкий горох, яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, соевые белки.
Имеются биологически активные пищевые добавки, содержащие изолейцин. При этом необходимо соблюдать правильный баланс между изолейцином и двумя другими разветвленными аминокислотами BCAA - лейцином и валином.
Лейцин
Лейцин - незаменимая аминокислота, вместе с изолейцином и валином относящаяся к трем разветвленным аминокислотам BCAA . Действуя вместе, они защищают мышечные ткани и являются источниками энергии, а также способствуют восстановлению костей, кожи, мышц, поэтому их прием часто рекомендуют в восстановительный период после травм и операций.
Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста. К пищевым источникам лейцина относятся бурый рис, бобы, мясо, орехи, соевая и пшеничная мука.
Биологически активные пищевые добавки, содержащие лейцин, применяются в комплексе с валином и изолейцином. Их следует принимать с осторожностью, чтобы не вызвать гипогликемии. Избыток лейцина может увеличить количество аммиака в организме.
Лизин
Лизин - незаменимая аминокислота, входящая в состав практически любых белков. Он необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых.
Эта аминокислота участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Лизин применяют в восстановительный период после операций и спортивных травм. Он также понижает уровень триглицеридов в сыворотке крови.
Лизин оказывает противовирусное действие, особенно в отношении вирусов, вызывающих герпес и острые респираторные инфекции. Прием добавок, содержащих лизин в комбинации с витамином С и биофлавоноидами, рекомендуется при вирусных заболеваниях.
Дефицит этой незаменимой аминокислоты может привести к анемии, кровоизлияниям в глазное яболко, ферментным нарушениям, раздражительности, усталости и слабости, плохому аппетиту, замедлению роста и снижению массы тела, а также к нарушениям репродуктивной системы.
Пищевыми источниками лизина являются сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Метионин
 Метионин - незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и на стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает дезинтоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Метионин - незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и на стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает дезинтоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Эту аминокислоту применяют в комплексной терапии ревматоидного артрита и токсикоза беременности. Метионин оказывает выраженное антиоксидантное действие, так как является хорошим источником серы, инактивирующей свободные радикалы. Его применяют при синдроме Жильбера, нарушениях функции печени. Метионин также необходим для синтеза нуклеиновых кислот, коллагена и многих других белков. Его полезно принимать женщинам, получающим оральные гормональные контрацептивы. Метионин понижает уровень гистамина в организме, что может быть полезно при шизофрении, когда количество гистамина повышено.
Метионин в организме переходит в цистеин, который является предшественником глютатиона. Это очень важно при отравлениях, когда требуется большое количество глютатиона для обезвреживания токсинов и защиты печени.
Пищевые источники метионина: бобовые, яйца, чеснок, чечевица, мясо, лук, соевые бобы, семена и йогурт.
Орнитин
Орнитин помогает высвобождению гормона роста, который способствует сжиганию жиров в организме. Этот эффект усиливается при применении орнитина в комбинации с аргинином и карнитином. Орнитин также необходим для иммунной системы и работы печени, участвуя в дезинтоксикационных процессах и восстановлении печеночных клеток.
Орнитин в организме синтезируется из аргинина и, в свою очередь, служит предшественником для цитруллина, пролина, глютаминовой кислоты. Высокие концентрации орнитина обнаруживаются в коже и соединительной ткани, поэтому эта аминокислота способствует восстановлению поврежденных тканей.
Нельзя давать биологически активные пищевые добавки, содержащие орнитин, детям, беременным и кормящим матерям, а также лицам с шизофренией в анамнезе.
Фенилаланин
Фенилаланин - это незаменимая аминокислота. В организме она может превращаться в другую аминокислоту - тирозин, которая, в свою очередь, используется в синтезе двух основных нейромедиаторов: допамина и норадреналина. Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, подавляет аппетит. Его используют в лечении артрита, депрессии, болей при менструации, мигрени, ожирения, болезни Паркинсона и шизофрении.
Фенилаланин встречается в трех формах: L-фенилаланин (естественная форма и именно она входит в состав большинства белков человеческого тела), D-фенилаланин (синтетическая зеркальная форма, обладает анальгирующим действием), DL-фенилаланин (объединяет полезные свойства двух предыдущих форм, ее обычно применяют при предменструальном синдроме.
Биологически активные пищевые добавки, содержащие фенилаланин, не дают беременным женщинам, лицам с приступами беспокойства, диабетом, высоким артериальным давлением, фенилкетонурией, пигментной меланомой.
Пролин
Пролин улучшает состояние кожи, за счет увеличения продукции коллагена и уменьшения его потери с возрастом. Помогает в восстановлении хрящевых поверхностей суставов, укрепляет связки и сердечную мышцу. Для укрепления соединительной ткани пролин лучше применять в комбинации с витамином С.
Пролин поступает в организм преимущественно из мясных продуктов.
Серин
Серин необходим для нормального обмена жиров и жирных кислот, роста мышечной ткани и поддержания нормального состояния иммунной системы.
Серин синтезируется в организме из глицина. В качестве увлажняющего вещества входит в состав многих косметических продуктов и дерматологических препаратов.
Таурин
Таурин в высокой концентрации содержится в сердечной мышце, белых клетках крови, скелетной мускулатуре, центральной нервной системе. Он участвует в синтезе многих других аминокислот, а также входит в состав основного компонента желчи, которая необходима для переваривания жиров, абсорбции жирорастворимых витаминов и для поддержания нормального уровня холестерина в крови.
Поэтому таурин полезен при атеросклерозе, отеках, заболеваниях сердца, артериальной гипертонии и гипогликемии. Таурин необходим для нормального обмена натрия, калия, кальция и магния. Он предотвращает выведение калия из сердечной мышцы и потому способствует профилактике некоторых нарушений сердечного ритма. Таурин оказывает защитное действие на головной мозг, особенно при дегидратации. Его применяют при лечении беспокойства и возбуждения, эпилепсии, гиперактивности, судорог.
Биологически активные пищевые добавки с таурином дают детям с синдромом Дауна и мышечной дистрофией. В некоторых клиниках эту аминокислоту включают в комплексную терапию рака молочной железы. Избыточное выведение таурина из организма встречается при различных состояниях и нарушениях обмена.
 Аритмии, нарушения процессов образования тромбоцитов, кандидозы, физический или эмоциональный стресс, заболевания кишечника, дефицит цинка и злоупотребление алкоголем приводят к дефициту таурина в организме. Злоупотребление алкоголем к тому же нарушает способность организма усваивать таурин.
Аритмии, нарушения процессов образования тромбоцитов, кандидозы, физический или эмоциональный стресс, заболевания кишечника, дефицит цинка и злоупотребление алкоголем приводят к дефициту таурина в организме. Злоупотребление алкоголем к тому же нарушает способность организма усваивать таурин.
При диабете увеличивается потребность организма в таурине, и наоборот, прием БАД, содержащих таурин и цистин, уменьшает потребность в инсулине. Таурин находится в яйцах, рыбе, мясе, молоке, но не встречается в белках растительного происхождения.
Он синтезируется в печени из цистеина и из метионина в других органах и тканях организма, при условии достаточного количества витамина В6. При генетических или метаболических нарушениях, мешающих синтезу таурина, необходим прием БАД с этой аминокислотой.
Треонин
Треонин - это незаменимая аминокислота, способствующая поддержанию нормального белкового обмена в организме. Она важна для синтеза коллагена и эластина, помогает работе печени и участвует в обмене жиров в комбинации с аспартовой кислотой и метионином.
Треонин находится в сердце, центральной нервной системе, скелетной мускулатуре и препятствует отложенную жиров в печени. Эта аминокислота стимулирует иммунитет, так как способствует продукции антител. Треонин очень в незначительных количествах содержится в зернах, поэтому у вегетарианцев чаще возникает дефицит этой аминокислоты.
Триптофан
Триптофан - это незаменимая аминокислота, необходимая для продукции ниацина. Он используется для синтеза в головном мозге серотонина, одного из важнейших нейромедиаторов. Триптофан применяют при бессоннице, депрессии и для стабилизации настроения.
Он помогает при синдроме гиперактивности у детей, используется при заболеваниях сердца, для контроля за массой тела, уменьшения аппетита, а также для увеличения выброса гормона роста. Помогает при мигренозных приступах, способствует уменьшению вредного воздействия никотина. Дефицит триптофана и магния может усиливать спазмы коронарных артерий.
К наиболее богатым пищевым источникам триптофана относятся бурый рис, деревенский сыр, мясо, арахис и соевый белок.
Тирозин
Тирозин является предшественником нейромедиаторов норэпинефрина и допамина. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь, приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина и улучшает функции надпочечников, щитовидной железы и гипофиза.
Тирозин также участвует в обмене фенилаланина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода. Поэтому неудивительно, что низкое содержание тирозина в плазме связано с гипотиреозом.
Симптомами дефицита тирозина также являются пониженное артериальное давление, низкая температура тела и синдром беспокойных ног.
 Биологически активные пищевые добавки с тирозином используют для снятия стресса, полагают, что они могут помочь при синдроме хронической усталости и нарколепсии. Их используют при тревоге, депрессии, аллергиях и головной боли, а также при отвыкании от лекарств. Тирозин может быть полезен при болезни Паркинсона. Естественные источники тирозина - миндаль, авокадо, бананы, молочные продукты, семечки тыквы и кунжут.
Биологически активные пищевые добавки с тирозином используют для снятия стресса, полагают, что они могут помочь при синдроме хронической усталости и нарколепсии. Их используют при тревоге, депрессии, аллергиях и головной боли, а также при отвыкании от лекарств. Тирозин может быть полезен при болезни Паркинсона. Естественные источники тирозина - миндаль, авокадо, бананы, молочные продукты, семечки тыквы и кунжут.
Тирозин может синтезироваться из фенилаланина в организме человека. БАД с фенилаланином лучше принимать перед сном или вместе с продуктами питания, содержащими большое количество углеводов.
На фоне лечения ингибиторами моноаминоксидазы (обычно их назначают при депрессии) следует практически полностью отказаться от продуктов, содержащих тирозин, и не принимать БАД с тирозином, так как это может привести к неожиданному и резкому подъему артериального давления.
Валин
Валин - незаменимая аминокислота, оказывающая стимулирующее действие, одна из аминокислот BCAA, поэтому может быть использована мышцами в качестве источника энергии. Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей и для поддержания нормального обмена азота в организме.
Валин часто используют для коррекции выраженных дефицитов аминокислот, возникших в результате привыкания к лекарствам. Его чрезмерно высокий уровень в организме может привести к таким симптомам, как парестезии (ощущение мурашек на коже), вплоть до галлюцинаций.
Валин содержится в следующих пищевых продуктах: зерновые, мясо, грибы, молочные продукты, арахис, соевый белок.
Прием валина в виде пищевых добавок следует сбалансировать с приемом других разветвленных аминокислот BCAA - L-лейцина и L-изолейцина.
Аминокислоты содержат амино - и карбоксильную группы и проявляют все свойства, характерные для соединений с такими функциональными группами. При написании реакций аминокислот пользуются формулами с неионизированными амино- и карбоксигруппами.
1)реакции по аминогруппе. Аминогруппа в аминокислотах проявляет обычные свойства аминов: амины являются основаниями, а в реакциях выступают в роли нуклеофилов.
1. Реакция аминокислот как основания. При взаимодействии аминокислоты с кислотами образуются аммонийные соли:
хлоргидрат глицина, хлороводородная соль глицина
2. Действие азотистой кислоты. При действии азотистой кислоты образуются гидроксикислоты и выделяется азот и вода:
Эту реакцию используют для количественного определения свободных аминных групп в аминокислотах, а также и в белках.
3.Образование N - ацильных производных, реакция ацилирования.
Аминокислоты реагируют с ангидридами и галогенангидридами кислот, образуя N - ацильные производные аминокислот:
Бензиловый эфир натриевая соль N карбобензоксиглицин - хлормуравьиной глицина
Ацилирование - один из способов защиты аминогруппы. N-ацильные производные имеют большое значение при синтезе пептидов, так как N-ацилпроизводные легко гидролизуются с образованием свободной аминогруппы.
4.Образование оснований Шиффа. При взаимодействии a - аминокислот с альдегидами образуются замещенные имины (основания Шиффа) через стадию образования карбиноламинов:
аланин формальдегид N-метилольное производное аланина
5.Реакция алкилирования. Амииногруппа в a -аминокислоте алкилируется с образованием N – алкилпроизводных:
Наибольшее значение имеет реакция с 2,4 - динитрофторбензолом. Получаемые динитрофенильные производные (ДНФ-производные) используются при установлении аминокислотной последовательности в пептидах и белках. Взаимодействие a- аминокислот с 2,4-динитрофторбензолом является примером реакции нуклеофильного замещения в бензольном ядре. За счет наличия в бензольном кольце двух сильных электроноакцепторных групп галоген становится подвижным и вступает в реакцию замещения:
2,4 – динитро -
фторбензол N - 2,4 - динитрофенил - a - аминокислота
(ДНФБ) ДНФ - производные a - аминокислот
6.Реакция с фенилизотиоцианатом. Эта реакция широко используется при установлении строения пептидов. Фенилизотиоцианат является производным изотиоциановой кислоты H-N=C=S. Взаимодействие a - аминокислот с фенилизотиоцианатом протекает по механизму реакции нуклеофильного присоединения. В образовавшемся продукте далее осуществляется внутримолекулярная реакция замещения, приводящая к образованию циклического замещенного амида: фенилтиогидантоин.
Циклические соединения получаются с количественным выходом и представляют собой фенильные производные тиогидантоина (ФТГ - производные) - аминокислот. ФТГ - производные различаются строением радикала R.
Кроме обычных солей a- аминокислоты могут образовывать в определенных условиях внутрикомплексные соли с катионами тяжелых металлов. Для всех a - аминокислот очень характерны красиво кристаллизующиеся, интенсивно окрашенные в синий цвет внутрикомплексные (хелатные) соли меди):
Этиловый эфир аланина
Образование сложных эфиров - один из методов защиты карбоксильной группы в синтезе пептидов.
3.Образование галогенангидридов. При действии на a- аминокислоты с защищенной аминогруппой оксидихлоридом серы (тионилхлоридом) или оксид-трихлоридом фосфора (хлорокисью фосфора) образуются хлорангидриды:
Получение галогенангидридов - один из способов активации карбоксильной группы в пептидном синтезе.
4.Получение ангидридов a - аминокислот. Галогенангидриды обладают очень высокой реакционной способностью, что снижает селективность реакции при их использовании. Поэтому более часто используемый способ активации карбоксильной группы в синтезе пептидов - это превращение ее в ангидридную. Ангидриды по сравнению с галогенангидридами кислот обладают меньшей активностью. При взаимодействии a- аминокислоты, имеющей защищенную аминогруппу, с этиловым эфиром хлормуравьиной кислоты(этилхлорформиатом) образуется ангидридная связь:
5. Декарбоксилирование. a - Аминокислоты, имеющие две электроноакцепторные группы при одном и том же атоме углерода, легко декарбоксилируются. В лабораторных условиях это осуществляется при нагревании аминокислот с гидроксидом бария.Эта реакция протекает в организме при участии ферментов декарбоксилаз с образованием биогенных аминов:
нингидрин
Отношение аминокислот к нагреванию. При нагревании a- аминокислот образуются циклические амиды, называемые дикетопиперазинами:
Дикетопиперазин
g - и d - Аминокислоты легко отщепляют воду и циклизуются с образованием внутренних амидов, лактамов:
g - лактам (бутиролактам)
В тех случаях, когда амино - и карбоксильная группы разделены пятью и более углеродными атомами, при нагревании происходит поликонденсация с образованием полимерных полиамидных цепей с отщеплением молекулы воды.