Твердые тела отличаются постоянством формы и объема и делятся на кристаллические и аморфные.
Кристаллические тела
Кристаллические тела (кристаллы) - это твердые тела, атомы или молекулы которых занимают упорядоченные положения в пространстве.Частицы кристаллических тел образуют в пространстве правильную кристаллическую пространственную решетку .
Каждому химическому веществу, находящемуся в кристаллическом состоянии, соответствует определенная кристаллическая решетка, которая задает физические свойства кристалла.
Знаете ли вы?
Много лет назад в Петербурге на одном из неотапливаемых складов лежали большие запасы белых оловянных блестящих пуговиц. И вдруг они начали темнеть, терять блеск и рассыпаться в порошок. За несколько дней горы пуговиц превратились в груду серого порошка. "Оловянная чума"
- так к прозвали эту «болезнь» белого олова.
А это была всего лишь перестройка порядка атомов в кристаллах олова. Олово, переходя из белой разновидности в серую, рассыпается в порошок.
И белое и серое олово - это кристаллы олова, но при низкой температуре изменяется их кристаллическая структура, а в результате меняются физические свойства вещества.
Кристаллы могут иметь различную форму и ограничены плоскими гранями.

В природе существуют:
а) монокристаллы
- это одиночные однородные кристаллы, имеющие форму правильных многоугольников и обладающие непрерывной кристаллической решеткой
Монокристаллы поваренной соли:

б) поликристаллы
- это кристаллические тела, сросшиеся из мелких, хаотически расположенных кристаллов.
Большинство твердых тел имеет поликристаллическую структуру (металлы, камни, песок, сахар).
Поликристаллы висмута:

Анизотропия кристаллов
В кристаллах наблюдается анизотропия - зависимость физических свойств (механической прочности, электропроводности, теплопроводности, преломления и поглощения света, дифракции и др.) от направления внутри кристалла.
Анизотропия наблюдается в основном в монокристаллах.
В поликристаллах (например, в большом куске металла) анизотропия в обычном состоянии не проявляется.
Поликристаллы состоят из большого количества мелких кристаллических зерен. Хотя каждый из них обладает анизотропией, но за счет беспорядочности их расположения поликристаллическое тело в целом утрачивает анизотропию.
Любое кристаллическое вещество плавится и кристаллизуется при строго определенной температуре плавления : железо — при 1530°,олово - при 232°, кварц - при 1713°, ртуть - при минус 38°.
Нарушить порядок расположения в кристалле частицы могут, только если он начал плавиться.
Пока есть порядок частиц, есть кристаллическая решетка - существует кристалл. Нарушился строй частиц - значит, кристалл расплавился - превратился в жидкость, или испарился - перешел в пар.
Аморфные тела
Аморфные тела не имеют строгого порядка в расположении атомов и молекул (стекло, смола, янтарь, канифоль).

В амофных телах наблюдается изотропия - их физические свойства одинаковы по всем направлениям.
При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства (при ударах раскалываются на куски как твердые тела) и текучесть (при длительном воздействии текут как жидкости).
При низких температурах аморфные тела по своим свойствам напоминают твердые тела, а при высоких температурах - подобны очень вязким жидкостям.
Аморфные тела не имеют определенной температуры плавления
, а значит,и температуры кристаллизации.
При нагревании они постепенно размягчаются.
Аморфные тела занимают промежуточное положение между кристаллическими твердыми телами и жидкостями.
Одно и то же вещество может встречаться и в кристаллическом и в некристаллическом виде.
В жидком расплаве вещества частицы движутся совершенно беспорядочно.
Если, например, расплавить сахар, то:
1. если расплав застывает медленно, спокойно, то частицы собираются в ровные ряды и образуются кристаллы. Так получается сахарный песок или кусковой сахар;

2. если остывание происходит очень быстро, то частицы не успевают построиться правильными рядами и расплав затвердевает некристаллическим. Так, если вылить расплавленный сахар в холодную воду или на очень холодное блюдце, образуется сахарный леденец, некристаллический сахар.
Удивительно!
С течением времени некристаллическое вещество может «переродиться», или, точнее, закристаллизоваться, частицы в них собираются в правильные ряды.
Только срок для разных веществ различен:для сахара это несколько месяцев, а для камня — миллионы лет.
Пусть леденец полежит спокойно месяца два-три.Он покроется рыхлой корочкой. Посмотрите на нее в лупу: это мелкие кристаллики сахара. В некристаллическом сахаре начался рост кристаллов. Подождите еще несколько месяцев — и уже не только корочка, но и весь леденец закристаллизуется.
Даже наше обыкновенное оконное стекло может закристаллизоваться. Очень старое стекло становится иногда совершенно мутным,потому что в нем образуется масса мелких непрозрачных кристаллов.
На стекольных заводах иногда в печи образуется «козел», то есть глыба кристаллического стекла. Это кристаллическое стекло очень прочное.Легче разрушить печь, чем выбить из нее упрямого «козла».
Исследовав его, ученые создали новый очень прочный материал из стекла - ситалл. Это стеклокристаллический материал, полученный в результате объёмной кристаллизации стекла.
Любопытно!
Могут существовать разные кристаллические формы одного и того же вещества
.
Например, углерод.

Графит - это кристаллический углерод. Из графита сделаны стержни карандашей, которые оставляют след на бумаге при легком надавливании. Структура графита слоиста. Слои графита легко сдвигаются, поэтому чешуйки графита пристают к бумаге при письме.
Но существует и другая форма кристаллического углерода - алмаз .
Твердым телом называется агрегатное состояние вещества, характеризующееся постоянством формы и объема, причем тепловые движения частиц в них представляют собой хаотические колебания частиц относительно положений равновесия.
Твердые тела подразделяются на кристаллические и аморфные.
Кристаллические тела – это твердые тела, имеющие упорядоченное периодически повторяющееся расположение частиц.
Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в тех измерениях, называется кристаллической решеткой.
Рисунок 53.1
Характерной особенностью кристаллов является их анизотропность – зависимость физических свойств (упругих, механических, тепловых, электрических, магнитных) от направления. Анизотропия кристаллов объясняется тем, что плотность расположения частиц по разным направлениям не одинакова.
Если кристаллическое тело состоит из единственного кристалла, оно называется монокристаллом. Если твердое тело состоит из множества беспорядочно ориентированных кристаллических зерен, оно называется поликристаллом. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов.
Твердые тела, физические свойства которых одинаковы по всем направлениям (изотропны), называются аморфными. Для аморфных тел, как и для жидкостей, характерен ближний порядок в расположении частиц, но, в отличие от жидкостей, подвижность частиц в них довольномала.
Органические аморфные тела, молекулы которых состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими связями, называются полимерами (например, каучук, полиэтилен, резина).
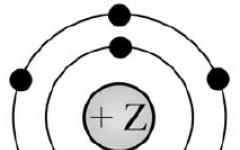
В зависимости от рода частиц, расположенных в узлах кристаллической решетки и от характера сил взаимодействия между частицами, различают 4 физических типа кристалла:
Ионные кристаллы , например, NaCl . В узлах кристаллической решетки находятся ионы разных знаков. Связь между ионами обусловлена силами кулоновского притяжения и называется такая связь гетерополярной.
Атомные кристаллы , например, С (алмаз), Ge, Si . В узлах решетки находятся нейтральные атомы, удерживающиеся там благодаря ковалентным связям, возникающим за счет обменных сил, имеющих чисто квантовый характер.
Металлические кристаллы . В узлах кристаллической решётки располагаются положительные ионы металла. Валентные электроны в металлах слабо связаны со своими атомами, они свободно перемещаются по всему объёму кристалла, образуя так называемый «электронный газ». Он связывает между собой положительно заряженные ионы.
Молекулярные кристаллы , например, нафталин,- в твёрдом состоянии (сухой лёд). Они состоят из молекул, связанных между собой силами Ван-дер-Ваальса, т.е. силы взаимодействия индуцированных молекулярных электрических диполей.
§ 54. Изменение агрегатного состояния
И в жидкостях и в твердых телах всегда есть некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам, и которые способны покинуть поверхность жидкости или твердого тела. Такой процесс для жидкости называется испарением (или парообразованием), для твердых тел – сублимацией (или возгонкой).
Конденсацией называется переход вещества вследствие его охлаждения или сжатия из газообразного состояния в жидкое.

Рисунок 54.1
Если число молекул, покидающих жидкость за единицу времени через единичную поверхность, равно числу молекул, переходящих из пара в жидкость, то наступает динамическое равновесие между процессами испарения и конденсации. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Плавлением называется переход вещества из кристаллического 9твердого) состояния в жидкое. Плавление происходит при определенной, возрастающей с увеличением внешнего давления, температуре плавления Т пл.

Рисунок 54.2
В процессе плавления теплота Q, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, и поэтому (рис. 54.2, а) до расплавления всего кристалла.
Количество теплоты L, необходимое для расплавления 1 кг вещества, называется удельной теплотой плавления .
Если жидкость охлаждать, то процесс пойдет в обратном направлении (рис. 54.2, б), - количество теплоты, отдаваемое телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равнойТ пл , начинается кристаллизация.
Для кристаллизации вещества необходимо наличие центров кристаллизации – кристаллических зародышей, которыми могут быть как кристаллики образующегося вещества, так и любые инородные включения. Если в чистой жидкости нет центров кристаллизации, то она может быть охлаждена до температуры, меньшей температуры кристаллизации, образуя, при этом переохлажденную жидкость (рис.б, - пунктир).
Аморфные тела являются переохлажденными жидкостями.
Кристаллические тела — твёрдые тела, в которых атомы расположены закономерно, образуя трёхмерно-периодическую пространственную укладку — кристаллическую решётку. Порядок атомов может быть дальний и ближний.
Аморфные тела не имеют кристаллической структуры и в отличие от кристаллов не расщепляются с образованием кристаллических граней. Также они, как правило, изотропны (не обнаруживают различных свойств в разных направлениях). Не имеют определённой точки плавления.
Кристаллы характеризуются пространственной периодичностью в расположении равновесных положений атомов. В аморфных телах атомы колеблются вокруг хаотически расположенных точек.
2.Что такое кристаллическая решётка?
Кристалли́ческая решётка - вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек (атомов), которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с центрами молекул.
3.Что такое узлы кристаллической решётки?
Точки размещния частиц
называют узлами кристаллической решѐтки.
В зависимости от типа частиц, расположенных в
узлах кристаллической решѐтки, и характера
связи между ними различают 4 типа
кристаллических решѐток: ионные, атомные,
молекулярные, металлические.
4.Чем отличаются монокристаллы от поликристаллов?
Монокристалл - отдельный однородный кристалл, имеющий непрерывную кристаллическую решётку и характеризующийся анизотропией свойств
Поликристалл — агрегат мелких кристаллов какого-либо вещества, иногда называемых из-за неправильной формы кристаллитами или кристаллическими зёрнами.
5.Как можно классифицировать кристаллы?
Виды кристаллов
Следует разделить идеальный и реальный кристалл.
Идеальный кристалл- Является, по сути, математическим объектом, имеющим полную, свойственную ему симметрию, идеализированно ровные гладкие грани.
Реальный кристалл- Всегда содержит различные дефекты внутренней структуры решетки, искажения и неровности на гранях и имеет пониженную симметрию многогранника вследствие специфики условий роста, неоднородности питающей среды, повреждений и деформаций. Реальный кристалл не обязательно обладает кристаллографическими гранями и правильной формой, но у него сохраняется главное свойство - закономерное положение атомов в кристаллической решётке.
6.Что такое ионная связь?
Ионная связь, электровалентная связь, гетеровалентная связь, один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
7.Что такое ковалентная связь?
Ковалентная связь, один из видов химической связи между двумя атомами, которая осуществляется общей для них электронной парой (по одному электрону от каждого атома). К. с. существует как в молекулах (в любых агрегатных состояниях), так и между атомами, образующими решетку кристалла.
8. Какие типы кристалл. систем Вы знаете?
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем.
1. триклинная сингония - наименьшая симметрия, нет одинаковых углов, нет осей одинаковой длины;
2. моноклинная сингония - два прямых угла, нет осей одинаковой длины;
3. ромбическая сингония - три прямых угла (поэтому ортогонально), нет осей одинаковой длины;
4. гексагональная сингония - две оси одинаковой длины в одной плоскости под углом 120°, третья ось под прямым углом;
5. тетрагональная сингония - две оси одинаковой длины, три прямых угла;
6. тригональная сингония - три оси одинаковой длины и три равных угла, не равных 90°;
7. кубическая сингония - высшая степень симметрии, три оси одинаковой длины под прямым углом.
Кристаллические тела и их свойства
В твёрдых телах частицы (молекулы, атомы и ионы) расположены настолько близко друг к другу, что силы взаимодействия между ними не позволяют им разлетаться.
Эти частицы могут лишь совершать колебательные движения вокруг положения равновесия. Поэтому твёрдые тела сохраняют форму и объём.
По своей молекулярной структуре твёрдые тела разделяются на кристаллические и аморфные .
Строение кристаллических тел

Кристаллическая решётка
Кристаллическими называют такие твёрдые тела, молекулы, атомы или ионы в которых располагаются в строго определённом геометрическом порядке, образуя в пространстве структуру, которая называется кристаллической решёткой .
Этот порядок периодически повторяется по всем направлениям в трёхмерном пространстве. Он сохраняется на больших расстояниях и не ограничен в пространстве. Его называют дальним порядком .
Типы кристаллических решёток
Кристаллическая решётка — это математическая модель, с помощью которой можно представить, как расположены частицы в кристалле. Мысленно соединив в пространстве прямыми линиями точки, в которых расположены эти частицы, мы получим кристаллическую решётку.
Расстояние между атомами, расположенными в узлах этой решётки, называется параметром решётки .
В зависимости от того, какие частицы расположены в узлах, кристаллические решётки бывают молекулярные, атомные, ионные и металлические .
От типа кристаллической решётки зависят такие свойства кристаллических тел, как температура плавления, упругость, прочность.
При повышении температуры до значения, при котором начинается плавление твёрдого вещества, происходит разрушение кристаллической решётки.
Молекулы получают больше свободы, и твёрдое кристаллическое вещество переходит в жидкую стадию. Чем прочнее связи между молекулами, тем выше температура плавления.
Молекулярная решётка

В молекулярных решётках связи между молекулами не прочные. Поэтому при обычных условиях такие вещества находятся в жидком или газообразном состоянии.
Твёрдое состояние для них возможно только при низких температурах. Температура их плавления (перехода из твёрдого состояния в жидкое) также низкая. А при обычных условиях они находится в газообразном состоянии.
Примеры — иод (I2), «сухой лёд» (двуокись углерода СО2).
Атомная решётка

В веществах, имеющих атомную кристаллическую решётку, связи между атомами прочные.
Поэтому сами вещества очень твёрдые. Плавятся они при высокой температуре. Кристаллическую атомную решётку имеют кремний, германий, бор, кварц, оксиды некоторых металлов и самое твёрдое в природе вещество — алмаз.
Ионная решётка

К веществам с ионной кристаллической решёткой относятся щёлочи, большинство солей, оксиды типичных металлов.
Так как сила притяжения ионов очень велика, то эти вещества способны плавиться только при очень высокой температуре. Их называют тугоплавкими. Они обладают высокой прочностью и твёрдостью.
Металлическая решётка

В узлах металлической решётки, которую имеют все металлы и их сплавы, расположены и атомы, и ионы.
Благодаря такому строению металлы обладают хорошей ковкостью и пластичностью, высокой тепло- и электропроводностью.
Чаще всего форма кристалла — правильный многогранник.
Грани и рёбра таких многогранников всегда остаются постоянными для конкретного вещества.
Одиночный кристалл называют монокристаллом . Он имеет правильную геометрическую форму, непрерывную кристаллическую решётку.
Примеры природных монокристаллов — алмаз, рубин, горный хрусталь, каменная соль, исландский шпат, кварц. В искусственных условиях монокристаллы получают в процессе кристаллизации, когда охлаждая до определённой температуры растворы или расплавы, выделяют из них твёрдое вещество в форме кристаллов.
При медленной скорости кристаллизации огранка таких кристаллов имеет естественную форму. Таким способом в специальных промышленных условиях получают, например, монокристаллы полупроводников или диэлектриков.
Мелкие кристаллики, беспорядочно сросшиеся друг с другом, называются поликристаллами . Ярчайший пример поликристалла — камень гранит. Все металлы также являются поликристаллами.
Анизотропия кристаллических тел

В кристаллах частицы расположены с различной плотностью по разным направлениям.
Если мы соединим прямой линией атомы в одном из направлений кристаллической решётки, то расстояние между ними будет одинаковым на всём этом направлении. В любом другом направлении расстояние между атомами тоже постоянно, но его величина уже может отличаться от расстояния в предыдущем случае. Это означает, что на разных направлениях между атомами действуют разные по величине силы взаимодействия. Поэтому и физические свойства вещества по этим направлениям также будут отличаться.
Это явление называется анизотропией — зависимостью свойств вещества от направления.
Электропроводность, теплопроводность, упругость, показатель преломления и другие свойства кристаллического вещества различаются в зависимости от направления в кристалле. По-разному в разных направлениях проводится электрический ток, по-разному нагревается вещество, по-разному преломляются световые лучи.
В поликристаллах явление анизотропии не наблюдается.
Свойства вещества остаются одинаковыми по всем направлениям.
Характеристика твердых тел.
Молекулы (или атомы) расположены строго упорядоченно. Расстояние между молекулами ≈ диаметру молекулы. Атомы или молекулы твердых тел колеблются около определенных положений равновесия.
Поэтому твердые тела сохраняют не только объем, но и форму. Если соединить центры положений равновесия атомом или ионов твердого тела, то получится правильная пространственная решетка, называемая кристаллической.
Твердые тела, в которых атомы или молекулы располо-жены упорядочение и образуют периодически повторяющуюся внутреннюю структуру, назы-ваются кристаллами. Поэтому кристаллы имеют плоские грани (Крупинка поваренной соли имеет плоские грани, составляющие друг с другом прямые углы).
Физические свойства кристал-лических тел неодинаковы в различных направлениях, но совпадают в параллельных на-правлениях.
Анизотропия кристаллов – это зависимость физических свойств от выбранного в кристалле направления.
Например, различная механическая прочность кристаллов по разным направлениям (Кусок слюды легко расслаивается в одном направлении, но разорвать его в направлении перпендикулярном пластинкам гораздо сложнее). Многие кристаллы по — разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Например, кристаллы кварца и турмалина по – разному преломляют свет в зависимости от направления падающих на него лучей.
Кристалл поваренной соли при раскалывании дробится на части, ограниченные пло-скими поверхностями, пересе-кающимися под прямыми угла-ми.
Эти плоскости перпендику-лярны особым направлениям в образце, по этим направлениям его прочность минимальна.
Анизотропия механических, тепловых, электрических и оп-тических свойств кристаллов объ-ясняется тем, что при упоря-доченном расположении атомов, молекул или ионов силы взаи-модействия между ними и меж-атомные расстояния оказывают-ся неодинаковыми по различным направлениям.
Кристаллические тела делят-ся на монокристаллы и поли-кристаллы.
Монокристаллы – это одиночные кристаллы имеют правильную геометрическую форму, и их свойства различны по разным направлениям (анизотропия).
Монокристаллы ино-гда обладают геометрически пра-вильной внешней формой, но главный признак монокристалла - периодически повторяю-щаяся внутренняя структура во всем его объеме.
Поликристал-лическое тело представляет собой совокупность сросшихся друг с другом хаотически ориентиро-ванных маленьких кристаллов - кристаллитов. Поликристалличе-скую структуру чугуна, напри-мер, можно обнаружить, если рассмотреть с помощью лупы образец на изломе. Каждый ма-ленький монокристалл поликри-сталлического тела анизотропен, но поликристаллическое тело изо-тропно.
Поликристаллы– это твердые тела состоящие из большого числа маленьких сросшихся кристалликов (металлы, кусок сахара).
Все направления внутри поликристаллов равноправны и свойства поликристаллов одинаковы по всем направлениям (изотропия).
Аморфными называются тела, физические свойства которых одинаковы по всем направле-ниям. Примерами аморфных тел могут служить куски затвердев-шей смолы, янтарь, изделия из стекла. Аморфные тела яв-ляются изотропными телами.
Изотропность физических свойств аморфных тел объясняется бес-порядочностью расположения со-ставляющих их атомов и моле-кул. У аморфных тел нет строгого порядка в расположении атомов, нет строгой повторяемости по всем направлениям одного и того же элемента структуры.
Определенной температуры плавления у аморфных тел в отличие от кристаллических нет.
Свойства аморфных тел. Все аморфные тела изотропны, т.е. их физические свойства по всем направлениям одинаковы (стекло, смола, пластмасса и т.д.).
При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства, подобно твердым телам, и текучесть, подобно жидкости (При сильном ударе кусок смолы раскалывается на кусочки, а при длительном нахождении смолы на твердой поверхности, смола постепенно растекается, и чем выше температура, тем быстрее это происходит.).
Тема 5.2 Механические свойства твердых тел. Виды деформаций. Упругость, прочность, пластичность, хрупкость. Закон Гука. Плавление и кристаллизация.
Внутреннее строение Земли и планет*
Деформацией твердого тела называется изменение формы или объема тела под действием внешних сил.
Виды деформации.
Упругие деформации – это деформации, которые полностью исчезают после прекращения действия внешних сил (пружина, резиновый шнур) и тело восстанавливает свою первоначальную форму.
Пластические деформации – это деформации, которые не исчезают после прекращения действия внешних сил (пластилин, глина, свинец) и тело не восстанавливает свою первоначальную форму.
Механическим напряжением называют отношение модуля силы упругости F к площади поперечного сечения S тела:
 ;
; 
Закон Гука: при малых деформациях напряжение прямо пропорционально относительному удлинению .
Закон Гука выполняется при небольших деформациях (участок ОА диаграммы).
1)  , где
, где  — модуль упругости или модуль Юнга (он характеризует сопротивляемость материала упругой деформации);
— модуль упругости или модуль Юнга (он характеризует сопротивляемость материала упругой деформации);  — относительная деформация (относительное удлинение); — начальная длина, ∆l – абсолютное удлинение тела.
— относительная деформация (относительное удлинение); — начальная длина, ∆l – абсолютное удлинение тела.
2)  , где
, где  — коэффициент жесткости.
— коэффициент жесткости.
Диаграмма растяжения. (рис.) Для исследования деформации растяжения стержень при помощи специальных устройств подвергают растяжению, а затем измеряют удлинение образца и возникающее в нем напряжение. По результатам опытов вычерчивают график зависимости напряжения от относительного удлинения , получивший название диаграммы растяжения (рис.).
 Участок ОА – пропорциональная деформация; — предел пропорциональности (максимальное напряжение, при котором еще выполняется закон Гука); если увеличивать нагрузку, то деформация становится нелинейной, но после снятия нагрузки форма и размеры тела практически восстанавливаются.
Участок ОА – пропорциональная деформация; — предел пропорциональности (максимальное напряжение, при котором еще выполняется закон Гука); если увеличивать нагрузку, то деформация становится нелинейной, но после снятия нагрузки форма и размеры тела практически восстанавливаются.
(Участок АВ- упругая деформация); — предел упругости; По мере увеличения нагрузки деформация нарастает все быстрее и при некотором значении напряжения, соответствующем на диаграмме точке С, удлинение нарастает практически без увеличения нагрузки.
Это явление называется текучестью материала (участок СD). Разрыв образца происходит после того, как напряжение достигает максимального значения , называемого пределом прочности (образец растягивается без увеличения внешней нагрузки вплоть до разрушения).
Похожая информация:
Поиск на сайте:
СТРОЕНИЕ И СВОЙСТВО ТВЕРДОГО ВЕЩЕСТВА
Теоретические сведения
Вещество может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Плазму часто называют четвертым агрегатным состоянием. Зависимость свойств вещества от агрегатного состояния указана в табл. 33.
Таблица 1
Свойства веществ в разных агрегатных состояниях
Агрегатное состояние вещества определяется силами, действующими между молекулами, расстоянием между частицами и характером их движения.
В твердом состоянии частицы занимают определенное положение относительно друг друга.
Вещество обладает низкой сжимаемостью, механической прочностью, поскольку молекулы не имеют свободы движения, а только колебания. Молекулы, атомы или ионы, образующие твердое вещество, называют структурными единицами.
Твердые вещества делятся на аморфные и кристаллические
(табл.
34). Кристаллические вещества плавятся при строго определенной температуре Тпл, аморфные – не имеют резко выраженной температуры плавления; при нагревании они размягчаются (характеризуются интервалом размягчения) и переходят в жидкое или вязкотекучее состояние рис.
Таблица 2
Сравнительная характеристика аморфных и кристаллических веществ

18. Изменение объема веществ при нагревании: а – кристаллических; б – аморфных
 |
Внутреннее строение аморфных веществ характеризуется беспорядочным расположением молекул(табл.
34). Кристаллическое состояние вещества предполагает правильное расположение в пространстве частиц, составляющих кристалл, и образованиемкристаллической (пространственной ) решетки Основной особенностью кристаллических тел является их анизотропия – неодинаковость свойств (тепло-, электропроводность, механическая прочность, скорость растворения и т. д.) по разным направлениям, в то время как аморфные тела – изотропны . Твердые кристаллы – трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Элементарная ячейка представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз. Задают элементарную ячейку с помощью осей и углов (рис. 19). |
Существуют основные параметры кристаллических решеток.
Энергия кристаллической решетки Екр., кДж/моль, –это энергия, которая выделяется при образовании 1 моля кристалла из микрочастиц (атомы, молекулы, ионы), находящихся в газообразном состоянии и удаленных друг от друга на расстояние, исключающее их взаимодействие.
Константа кристаллической решетки d, –наименьшее расстояние между центром двух частиц в кристалле, соединенных химической связью.
Координационное число к.ч.
–число частиц, окружающих в пространстве центральную частицу, связанных с ней химической связью.
Точки, в которых размещены частицы кристалла, называются узлами кристаллической решетки
Несмотря на многообразие форм кристаллов, их можно строго и однозначно классифицировать. Систематизация форм кристаллов была введена русским академиком А.В. Гадолиным (1867), она основана на особенностях симметрии кристаллов. В соответствии с геометрической формой кристаллов возможны следующие их системы (сингонии): кубическая, тетрагональная, орторомбическая, моноклинная, триклинная, гексагональная и ромбоэдрическая (рис.

Рис. 20. Основные системы кристаллов
Одно и то же вещество может иметь различные кристаллические формы, которые отличаются по внутреннему строению, а значит, и по физико-химическим свойствам. Такое явление называется полиморфизмом .
Изоморфизм –два разных по природе вещества образуют кристаллы одинаковой структуры. Такие вещества могут замещать друг друга в кристаллической решетке, образуя смешанные кристаллы.
В зависимости от вида частиц, находящихся в узлах кристаллической решетки и типа связей между ними кристаллы бывают четырех типов: молекулярные, атомные, ионные и металлические (рис.

21. Виды кристаллов
Кристаллические решетки, состоящие из молекул (полярных и неполярных) называются молекулярными . Молекулы в таких кристаллических решетках соединены между собой сравнительно слабыми водородными, межмолекулярными и электростатическими силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления. Они малорастворимы в воде, не проводят электрический ток и обладают высокой летучестью.
Примерами веществ с молекулярными решетками являются лед, твердый углекислый газ («сухой лед»), твердые галогенводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Cl2, Br2, J2, H2, N2,O2), трех- (O3), четырех- (P4), восьми- (S8) атомными молекулами.
Большинство кристаллических органических соединений также имеют молекулярную решетку.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называют атомными (ковалентными) .
Атомы в таких решетках соединены между собой прочными ковалентными связями.
Примером кристалла с атомной кристаллической решеткой может служить алмаз (рис. 21) – одна из модификаций углерода. Данный кристалл состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами (к.ч. = 4).
Число веществ с атомной кристаллической решеткой велико.
Все они имеют высокую температуру плавления, не растворимы в жидкостях, обладают высокой прочностью, твердостью, имеют широкий диапазон электропроводимости (от изоляторов и полупроводников до электронных проводников). Атомная кристаллическая решетка характерна для элементов III и IV групп главных подгрупп (Si, Ge, B, C).
Кристаллические решетки, состоящие из ионов, называются ионными . Их образуют вещества с ионной связью. Примером образования ионной кристаллической решетки может служить кристалл хлорида натрия (NaCl ) (рис.
21). Вещества с ионной кристаллической решеткой обладают высокой твердостью, хрупкостью, являются тугоплавкими и малолетучими. Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и ослаблению прочности связи между ними. Поэтому расплавы, растворы таких кристаллов проводят электрический ток. Вещества с ионными кристаллическими решетками легко растворяются в полярных жидкостях, являются диэлектриками.
Ионные кристаллические решетки образуют многие соли, оксиды, основания.
Кристаллическая решетка, состоящая из атомов и ионов металлов, соединенных металлической связью (рис. 21), называется металлической .
Металлическая решетка является, как правило, весьма прочной. Этим объясняются свойственные большинству металлов твердость, малая летучесть, высокая температура плавления и кипения.
Она же обусловливает такие характерные свойства металлов как электро- и теплопроводность, блеск, ковкость, пластичность, непрозрачность, фотоэффект. Металлической кристаллической решеткой обладают чистые металлы и сплавы.
Подробности Категория: Молекулярно-кинетическая теория Опубликовано 14.11.2014 17:19 Просмотров: 15569В твёрдых телах частицы (молекулы, атомы и ионы) расположены настолько близко друг к другу, что силы взаимодействия между ними не позволяют им разлетаться. Эти частицы могут лишь совершать колебательные движения вокруг положения равновесия. Поэтому твёрдые тела сохраняют форму и объём.
По своей молекулярной структуре твёрдые тела разделяются на кристаллические и аморфные .
Строение кристаллических тел

Кристаллическая решётка
Кристаллическими называют такие твёрдые тела, молекулы, атомы или ионы в которых располагаются в строго определённом геометрическом порядке, образуя в пространстве структуру, которая называется кристаллической решёткой . Этот порядок периодически повторяется по всем направлениям в трёхмерном пространстве. Он сохраняется на больших расстояниях и не ограничен в пространстве. Его называют дальним порядком .
Типы кристаллических решёток
Кристаллическая решётка - это математическая модель, с помощью которой можно представить, как расположены частицы в кристалле. Мысленно соединив в пространстве прямыми линиями точки, в которых расположены эти частицы, мы получим кристаллическую решётку.
Расстояние между атомами, расположенными в узлах этой решётки, называется параметром решётки .
В зависимости от того, какие частицы расположены в узлах, кристаллические решётки бывают молекулярные, атомные, ионные и металлические .
От типа кристаллической решётки зависят такие свойства кристаллических тел, как температура плавления, упругость, прочность.
При повышении температуры до значения, при котором начинается плавление твёрдого вещества, происходит разрушение кристаллической решётки. Молекулы получают больше свободы, и твёрдое кристаллическое вещество переходит в жидкую стадию. Чем прочнее связи между молекулами, тем выше температура плавления.
Молекулярная решётка

В молекулярных решётках связи между молекулами не прочные. Поэтому при обычных условиях такие вещества находятся в жидком или газообразном состоянии. Твёрдое состояние для них возможно только при низких температурах. Температура их плавления (перехода из твёрдого состояния в жидкое) также низкая. А при обычных условиях они находится в газообразном состоянии. Примеры - иод (I 2), «сухой лёд» (двуокись углерода СО 2).
Атомная решётка

В веществах, имеющих атомную кристаллическую решётку, связи между атомами прочные. Поэтому сами вещества очень твёрдые. Плавятся они при высокой температуре. Кристаллическую атомную решётку имеют кремний, германий, бор, кварц, оксиды некоторых металлов и самое твёрдое в природе вещество - алмаз.
Ионная решётка

К веществам с ионной кристаллической решёткой относятся щёлочи, большинство солей, оксиды типичных металлов. Так как сила притяжения ионов очень велика, то эти вещества способны плавиться только при очень высокой температуре. Их называют тугоплавкими. Они обладают высокой прочностью и твёрдостью.
Металлическая решётка

В узлах металлической решётки, которую имеют все металлы и их сплавы, расположены и атомы, и ионы. Благодаря такому строению металлы обладают хорошей ковкостью и пластичностью, высокой тепло- и электропроводностью.
Чаще всего форма кристалла - правильный многогранник. Грани и рёбра таких многогранников всегда остаются постоянными для конкретного вещества.
Одиночный кристалл называют монокристаллом . Он имеет правильную геометрическую форму, непрерывную кристаллическую решётку.
Примеры природных монокристаллов - алмаз, рубин, горный хрусталь, каменная соль, исландский шпат, кварц. В искусственных условиях монокристаллы получают в процессе кристаллизации, когда охлаждая до определённой температуры растворы или расплавы, выделяют из них твёрдое вещество в форме кристаллов. При медленной скорости кристаллизации огранка таких кристаллов имеет естественную форму. Таким способом в специальных промышленных условиях получают, например, монокристаллы полупроводников или диэлектриков.
Мелкие кристаллики, беспорядочно сросшиеся друг с другом, называются поликристаллами . Ярчайший пример поликристалла - камень гранит. Все металлы также являются поликристаллами.
Анизотропия кристаллических тел

В кристаллах частицы расположены с различной плотностью по разным направлениям. Если мы соединим прямой линией атомы в одном из направлений кристаллической решётки, то расстояние между ними будет одинаковым на всём этом направлении. В любом другом направлении расстояние между атомами тоже постоянно, но его величина уже может отличаться от расстояния в предыдущем случае. Это означает, что на разных направлениях между атомами действуют разные по величине силы взаимодействия. Поэтому и физические свойства вещества по этим направлениям также будут отличаться. Это явление называется анизотропией - зависимостью свойств вещества от направления.
Электропроводность, теплопроводность, упругость, показатель преломления и другие свойства кристаллического вещества различаются в зависимости от направления в кристалле. По-разному в разных направлениях проводится электрический ток, по-разному нагревается вещество, по-разному преломляются световые лучи.
В поликристаллах явление анизотропии не наблюдается. Свойства вещества остаются одинаковыми по всем направлениям.
Тела, которые в обыденной жизни называют твердыми, отличаются от жидкостей отсутствием способности течь. Не обладая текучестью, твердые тела сохраняют неизменной свою форму. Жидкости же и газы принимают форму сосуда, в котором они находятся. Как мы увидим в дальнейшем, с молекулярной точки зрения приведенное выше определение неточно.
Разнообразные твердые тела, с которыми человеку приходится иметь дело в своей практической деятельности, можно разделить на две группы, существенно различающиеся по своим свойствам. Одну группу образуют тела кристаллические, другую - аморфные.
Одной из основных особенностей кристаллических тел является анизотропия, т. е. зависимость свойств макроскопически однородного тела от направления. Если исследовать такие характеристики физических свойств тела, как показатель преломления световых лучей, коэффициент теплопроводности, модуль упругости и т. п., то окажется, что в кристалле в зависимости от направления эти величины могут иметь разное значение. Иными словами, в различных направлениях кристалл обладает различной теплопроводностью, различной упругостью, различной способностью преломлять световые лучи.
Анизотропия - характерная особенность кристаллов. Аморфные тела не обладают анизотропией. Если исследовать различные физические свойства стекла, которое является типичным представителем аморфного тела, то окажется, что во всех направлениях его свойства одинаковы.
Независимость физических свойств тела от направления называют изотропностью. Аморфные тела изотропны. Изотропность аморфных твердых тел является проявлением сходства их молекулярной структуры с молекулярной структурой жидкостей. Можно считать, что твердые аморфные тела - это жидкости,
вязкость которых при понижении температуры настолько возросла, что они потеряли способность течь, сохранив при этом молекулярную структуру, характерную для жидкости.
Следует указать на то, что подавляющее большинство материалов, используемых человеком в его практической деятельности, изотропны. Это и понятно, поскольку, как правило, практическое использование анизотропных материалов затруднительно. В то же время большая часть материалов, применяемых в технике и строительном деле, таких, например, как железо, медь, цинк, гранит и т. д., является кристаллическими, а следовательно, анизотропными веществами. Использование этих материалов возможно тем не менее в силу того, что анизотропия характерна только для отдельных больших кристаллов, так называемых монокристаллов. Технические же материалы представляют собой тела, образованные соединенными вместе маленькими кристалликами. Такие тела называют поликристаллическими. Чем меньше кристаллики, образующие поликристаллическое тело, тем более оно однородно и одновременно более изотропно. В тех случаях, когда необходима высокая изотропность материала, он должен быть возможно более мелкокристаллическим.
Бывают, однако, случаи, когда желательно получить отдельный монокристалл больших размеров. Для этой цели разработаны специальные методы выращивания больших кристаллов, позволяющие получать монокристаллы с линейными размерами в десятки сантиметров.
Многие тела (сера, глицерин, сахар и т. п.) могут существовать как в кристаллической, так и в аморфной, или, как часто говорят, в стеклообразной, форме.
Если расплавленную и нагретую до температуры около 350° серу быстро охладить, вылив ее в холодную воду, она превращается не в обычную кристаллическую серу, а в аморфную пластическую. Свойства аморфной серы не похожи на свойства серы кристаллической. Кристаллическая сера хрупка, аморфная же пластическая сера легко изменяет свою форму при сравнительно небольшом давлении, напоминая в этом отношении пластилин.
Как правило, аморфная форма твердого тела менее устойчива, чем кристаллическая. Аморфные тела самопроизвольно, хотя и очень медленно, превращаются в кристаллические. В случае стекла этот процесс сопровождается появлением микроскопических трещин и называется расстекловыванием.
Следует, однако, отметить, что процесс кристаллизации аморфного тела может протекать столь медленно, что аморфное состояние будет практически полностью устойчиво. Так, например, янтарь, являющийся аморфным телом, так же как и другие ископаемые смолы, образовался десятки миллионов лет назад, однако в нем не обнаруживается никаких признаков кристаллизации, и он может рассматриваться как полностью устойчивое аморфное вещество.
Различие между аморфными и кристаллическими телами проявляется при переходе их в жидкое состояние, т. е. при плавлении. Для уяснения этого различия проделаем следующий опыт: будем нагревать мелко измельченное твердое тело и наблюдать происходящие при этом изменения температуры, отмечая через определенные промежутки времени показания прибора, измеряющего температуру, и откладывая эти величины в качестве ординат на графике (рис. 67), на котором вдоль оси абсцисс отложено время нагрева Если соединить между собой найденные таким образом точки, то в случае кристаллического тела возникнет кривая, изображенная на графике сплошной линией.

Рис. 67. Плавление твердого кристаллического тела и аморфного тела.
Первоначально нагрев твердого тела сопровождается повышением его температуры, возрастающей приблизительно прямо пропорционально времени нагрева (отрезок При достижении температуры плавления дальнейший рост температуры прекращается, несмотря на нагревание тела (отрезок Подводимое тепло в этом случае расходуется на плавление кристалла (теплота плавления). После того как все твердое тело расплавится (точка С), температура при дальнейшем подводе теплоты начинает вновь возрастать (отрезок
Иная картина наблюдается при нагревании аморфного твердого тела. В этом случае отсутствует резко выраженная температура плавления. На соответствующей кривой (пунктирная кривая на рис. 67) наблюдается только изменение скорости возрастания температуры. В некотором, не резко ограниченном интервале температур, соответствующем области размягчения аморфного тела, скорость возрастания температуры уменьшается. Вязкость аморфного твердого тела в области размягчения падает и тело превращается из твердого в жидкое.
Кроме указанных выше особенностей, кристаллы отличаются от аморфных тел наличием правильной формы. Иногда правильная форма кристаллического тела бывает искажена особыми условиями роста кристаллов или же механической обработкой. Однако наличие правильной формы кристаллов у кристаллических твердых тел всегда можно установить по характеру их излома. Излом кристаллического тела имеет шероховатую поверхность, образованную кристалликами правильной формы больших или меньших размеров. Излом же аморфного тела имеет гладкую поверхность с характерными острыми краями, хорошо знакомыми по излому стекла.
Внешняя форма отдельных кристалликов может сильно изменяться в зависимости от условий роста кристалла. Последнее особенно бросается в глаза при рассматривании причудливых форм снежинок.
Для учения о кристаллах чрезвычайно важно то, что вне зависимости от внешней формы кристалла углы между его гранями имеют всегда постоянную, определенную для данного типа кристалла величину. В тех случаях, когда рост кристалла не искажен какими-либо внешними причинами, его форма определяется принципом минимума свободной поверхностной энергии. При этом следует помнить, что различные грани кристалла характеризуются различной поверхностной энергией, и при росте кристалла грани с малой поверхностной энергией получают наибольшее развитие. В целом же равновесная форма кристалла такова, что его суммарная поверхностная энергия минимальна.